时间:2019-06-28 21:22:52
1、填空题 (1)FeCl3的水溶液呈______(填“酸”、“中”、“碱”)性,常温时的pH______7(填“>”、“=”、“<”),原因是(用离子方程式表示):______;实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”、“抑制”)其水解.
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______.
参考答案:(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe3++3H2O?Fe(OH)3+2H+;抑制;
(2)硫化钠为强碱弱酸盐,硫离子水解而使其溶液呈碱性,水解离子方程式为S2-+H2O?HS-+OH-,在配制硫化钠溶液时,为防止其水解,可以加入少量NaOH,
故答案为:NaOH.
本题解析:
本题难度:一般
2、简答题 已知:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32-.现有浓度为0.1mol?L-1的五种电解质溶液:①Na2CO3?②NaHCO3③NaAlO2④CH3COONa?⑤NaOH
(1)这五种溶液的pH由小到大的顺序是______(填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是______(填编号);
(3)混合碳酸(H2CO3)溶液和NaAlO2溶液,试写出可能发生的化学反应方程式:______;
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH 甲 0.20 0.20 pH=a 乙 0.10 0.10 pH=8.00 |
参考答案:(1):④、②、①、③是盐,⑤是碱,物质的量浓度相同的这几种溶液,盐的PH值小于碱的,所以⑤的PH值最大;④、②、①、③四种盐的阳离子相同,其阴离子相应的酸越弱,盐的PH值越大,醋酸的酸性>碳酸的酸性>偏铝酸的酸性,碳酸氢钠是酸式盐,碳酸钠是正盐,所以碳酸钠的PH值大于碳酸氢钠的,故相同物质的量浓度的这几种溶液的PH值由小到大的顺序是④②①③⑤.
故答案为:④②①③⑤.
?(2)④②①③都存在水解平衡,当稀释时,盐又水解出部分离子进行补充;氢氧化钠是强碱,完全电离,不存在电离平衡,所以当稀释时,其pH变化最大.
故答案为:⑤.
(3)碳酸的酸性大于偏铝酸的酸性,碳酸能和偏铝酸钠反应生成碳酸氢钠和氢氧化铝,
NaAlO2+H2CO3+H2O=NaHCO3+Al(OH)3↓;碳酸氢钠能电离出氢离子,氢离子和偏铝酸钠反应生成碳酸钠和氢氧化铝
NaHCO3+NaAlO2+H2O=Na2CO3+Al(OH)3↓.
故答案为:NaAlO2+H2CO3+H2O=NaHCO3+Al(OH)3↓、NaHCO3+NaAlO2+H2O=Na2CO3+Al(OH)3↓.
(4)酸、碱的物质的量相等,即酸、碱恰好反应生成盐,若盐溶液的a=7时,该盐是强酸强碱盐,HA是强酸;a>7时,该盐是强碱弱酸盐,HA是弱酸;
?乙组实验:PH=8,所以C(H+)=10-8 mol/L,根据C(H+).C(OH-)=10-14,所以c?(OH-)=10-6 mol/L;
Ⅰ根据电荷守恒知,C(H+)+C(Na+ )=C(OH-)+C(A- ),所以c?(Na+)-c?(A-)=C(OH-)-C(H+)=(10-6-10-8)mol/L.
Ⅱ根据物料守恒和电荷守恒计算,C(H+)+C(Na+ )=C(OH-)+C(A- ),C(A- )+C(HA)=0.05mol/L,
C(Na+ )=0.05mol/L?
所以c?(OH-)-c?(HA)=C(H+)=10-8 mol/L.
故答案为:a=7时,HA是强酸;a>7时,HA是弱酸;(10-6-10-8)mol/L;=10-8 mol/L,;
本题解析:
本题难度:一般
3、推断题 已知由短周期常见元素形成的纯净物A、B、C、D、E转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的 某种相同)。 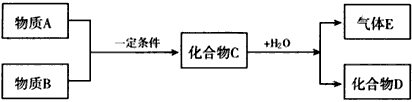
回答下列问题:
(1)若A为金属单质,C是淡黄色固体,D是一元强碱。
①写出A的离子结构示意图:_____________;
②C的电子式为____________;
③D与等物质的量的醋酸反应所得溶液的pH_______(填“>”“<”或“=”)7,若在常温下,向pH=a的醋酸溶液中加入等体积pH=b的D溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是___________。
(2)若A为非金属单质,C是有色气体,D是一元强酸。
①写出A与B反应的化学方程式:__________________。
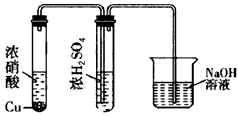
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是:
___________________ 
③已知常温下1 mol气体C与H2O反应生成D溶液和E气体放出46kJ热量, 写出气体C与H2O反应生成D溶液和E气体的热化学方程式:__________________
参考答案:(1)①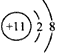 ;②
;②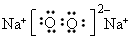 ;③>;c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
;③>;c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(2)①2NO+O2=2NO2;②NO2能溶于浓硫酸中(浓硫酸可以吸收NO2),浓硫酸不能干燥NO2;
③3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) △H=-138 kJ/mol
本题解析:
本题难度:一般
4、填空题 常温下,有浓度均为0.1mol/L的4种溶液:①盐酸;②硫酸;③醋酸;⑧氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH =7的组合有(填序号)____。
(2)醋酸钡是易溶于水的强电解质。将③和③等体积混合, 所得溶液中离子浓度由大到小的顺序是____。
参考答案:(1)②和④
(2)c(OH-)>c(Ba2+)>c(CH3COO-)>c(H+)
本题解析:
本题难度:一般
5、选择题 常温下,将aL0.1 mol/L的NaOH溶液与 b L0.l mol/L的CH3COOH溶液混合,下列有关混合溶液的说法不正确的是
[? ]
A.a<b时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.a=b时,c(CH3COOH)+c(H+)=c(OH-)
D.无论a、b有何关系,均有c(H+)+c(Na+)= c(CH3COO-)+c(OH-)
参考答案:B
本题解析:
本题难度:一般