时间:2019-06-28 21:06:42
1、选择题 人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为 Zn+2OH--2e-=ZnO+H2↑,
Ag2O+H2O+2e-==2Ag+2OH-。据此判断Ag2O是
[? ]
A.负极,被氧化
B.正极,被还原
C.负极,被还原
D.正极,被氧化
参考答案:B
本题解析:
本题难度:一般
2、填空题 甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同): 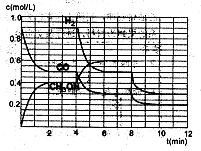
①下列说法正确的是
A.起始时n(H2)为1.7mol
B.当容器内压强恒定时,说明反应达到平衡状态
C.4分钟时,改变的条件是升高温度
D.7分钟时,v(CO)=v(CH3OH)
②计算0~2min内平均反应速率v(H2)=
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。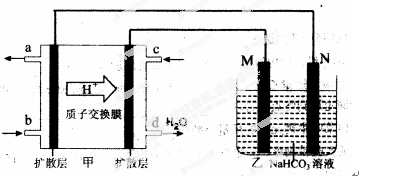
①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
参考答案:化学反应式或方程式未配平的均扣1分
(1)CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ/mol (2分,方程式1分,反应热2分,状态错误扣1分,计量数错误不得分。)
(2) ① BD (2分,少选扣1分,有错选不得分)
② 0.4mol/(L·min) 或6.67×10-3 mol·L-1·s-1(2分,无单位不得分)
③ 0.99 (2分,数值在1.0~0.98之间均得分,写成“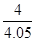 ”或“
”或“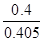 ” 得1分,单位不做要求。)
” 得1分,单位不做要求。)
④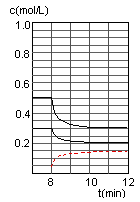
(3)① CH3OH-6e-+H2O=CO2↑+6 H+ (2分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
② 铝制品(1分,写“Al”或“铝”均可,其他书写不得分)
2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O(3分,或“Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+3CO2↑,2Al(OH)3=Al2O3+3H2O”各1分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
本题解析:(1)先写出三种物质的燃烧热的热化学方程式。
① CO(g)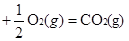 △H1=-283.0kJ/mol
△H1=-283.0kJ/mol
② H2(g)+ 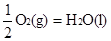 △H2=-285.8 kJ/mol
△H2=-285.8 kJ/mol
③ CH3OH(1)+ 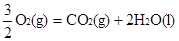 △H3=-726.5kJ/mol
△H3=-726.5kJ/mol
再写出目标方程式:CO(g)+2H2(g)=CH3OH(l) △H4
根据盖斯定律, ①+②×2-③即得到目标方程式。 △H4= △H1+△H2×2-△H3=-128.1kJ/mol
根据图像: CO(g)+2H2(g)=CH3OH(l)
起始:(mol/L) 0.9 x 0
0-2min(mol/L) —0.4 —0.8 0.4
2-4min(mol/L)(平衡) 0.5 0.9 0.4
4-6min(mol/L) —0.2 —0.4 0.2
6-8min(mol/L)(平衡) 0.3 0.5 0.6
8-10min(mol/L) —0.1 —0.2 0.1
10-12min(mol/L)(平衡)0.2 0.3 y
①A项,起始时浓度x=C(H2)为1.7mol/L,容器体积未知,所以物质的量也未知,A项错误。
B项,该容器是一个恒容的容器,反应是一个非等体积反应,因此当气体的总物质的量不再改变,即压强不再改变,反应即达到平衡状态,正确。
C项,4min时,平衡向右移,并且各物质的浓度是逐渐变化,所以应该是降温的条件下,C项错误。
D项,7min时,反应再次达到平衡,此时v(CO)=v(CH3OH),D项正确。
②0~2min内平均反应速率v(H2)= ="0.4" mol·L-1·min-1
="0.4" mol·L-1·min-1
③在3min时该反应的平衡常数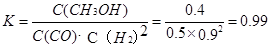
④在第8min时,CO的浓度减少0.1mol·L-1,H2的浓度减少0.2mol·L-1,可知平衡在向右移动,CO和H2的浓度都是逐渐变小,而此时的条件和上次平衡移动的条件不相同,所以只能是减少甲醇的浓度,才能使平衡向右移动,即在平衡移动的瞬间,甲醇的浓度是很少的,应该要低于0.05mol·L-1,然后再增加0.1mol·L-1,在第10min平衡,并且浓度y不超过0.15mol·L-1。
(3)该装置中甲是一个燃料电池装置,给右边的装置乙提供电能,乙装置是一个电解池装置。
①甲中质子移向右边,从而推知甲装置左是负极,右是正极,则乙装置中M是阳极,N是阴极。甲中电池的负极反应式为:CH3OH-6e-+H2O=CO2↑+6 H+ 要注意电解质溶液质子在进行传递。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。则阳极M材料是铝制品,阴极N材料是石墨。在铝表面钝化,即把铝变成Al2O3,同时考虑溶液中溶质为NaHCO3,则电极反应为:2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O
考点: 考查热化学方程式的书写、化学平衡原理及其图像问题、电化学综合。
本题难度:困难
3、选择题 下图所示的锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越。则下列叙述正确的是 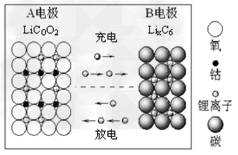
[? ]
A.?充电过程中,B极被氧化
B.?该电池充放电的总反应式为: LiCoO2+C6 Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
C.?放电时A极是负极,C6X-发生氧化反应
D.?放电时B极是负极,?Li发生氧化反应
参考答案:B
本题解析:
本题难度:一般
4、选择题 某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3 (g)?△H<0。下列分析正确的是?(?)
2NH3 (g)?△H<0。下列分析正确的是?(?)
A.平衡后加入N2,该反应的△H增大
B.若平衡昏升高温度,则平衡常数K变大
C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大
D.若反应前充人的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
参考答案:C
本题解析:略
本题难度:一般
5、选择题 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是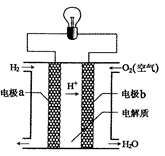
A.该电池的总反应:2H2+O2=2H2O
B.该电池中电极b是负极
C.外电路中电子由电极b通过导线流向电极a
D.该电池工作时电能转化为化学能
参考答案:A
本题解析:试题分析:根据原电池的工作原理可知,负极电极反应式2H2-4 e-=4H+,正极电极反应式为O2+4H++4e-=2H2O,正负极电极反应式相加得电池反应式2H2+O2=2H2O,故A正确;氢氧燃料电池中,通入氢气的一极为电源的负极,所以电极a是负极,故B错误;氢氧燃料电池中,通入氧气的一极为电源的正极,发生还原反应,外电路中电子由电极a通过导线流向电极b,故C错误;氢氧燃料电池中是把化学能转化为电能,故D错误,答案选A。
考点:考查氢氧燃料电池的有关判断
点评:该题以氢氧燃料电池为载体,重点考查学生对原电池原理的熟悉了解程度,实验中等难度的试题。注意电极方程式的书写,电极反应式与电解质溶液的酸碱性有关,电极反应式相加时,得失电子数必须相等等。
本题难度:简单