时间:2019-06-28 21:02:17
1、选择题 质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水,得到的溶液密度为q g/cm3(此过程中无溶质析出),物质的量浓度为c mol·L-1。则溶质的相对分子质量为
A.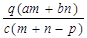
B.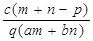
C.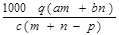
D.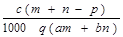
参考答案:C
本题解析:蒸发掉p g水后溶质质量分数为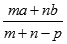 ,c=
,c=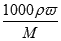 可知,溶质的摩尔质量M=
可知,溶质的摩尔质量M=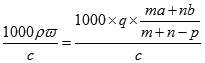 g/mol=
g/mol=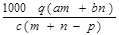 ,故答案为C.
,故答案为C.
考点:物质的量浓度的计算
本题难度:困难
2、实验题 (1)通过计算,配制100mL1.00mol/L的氯化钠溶液所需氯化钠的质量,如果是用分析天平(或电子天平)进行称量,所称量的质量是? g;如果是用托盘天平称量,所称得的质量是? g。存在上述差别的原因是? 。
(2)实验中,当改用胶头滴管向容量瓶中加入蒸馏水时,若不小心蒸馏水加多了,液面远远超过了容量瓶上的刻度线,则所配制的溶液的物质的量浓度将偏? (填“高”或“低”)。
参考答案:(1)5.85;5.9;托盘天平只能精确到0.1g,而分析天平能精确到0.01g ,
(2)低
本题解析:
本题难度:一般
3、选择题 下列溶液中Cl-浓度最小的是( )
A.250mL1mol/LAlCl3溶液
B.200mL2mol/LMgCl2溶液
C.1L2.5mol/LNaCl溶液
D.300mL5mol/LKClO3溶液
参考答案:A、250mL1mol/LAlCl3溶液中Cl-浓度为3mol/L;
B、200mL2mol/LMgCl2溶液中Cl-浓度为4mol/L;
C、1L 2.5 mol/LNaCl溶液中Cl-浓度为2.5mol/L;
D、KClO3电离产生K+和ClO3-,无Cl-,所以Cl-浓度为0,
故选:D.
本题解析:
本题难度:简单
4、选择题 现需要物质的量浓度约为2 mol·L-1的NaOH溶液100 mL,下面的操作正确的是(? )
A.称取7.8 g Na2O2固体,放入250 mL烧杯中,用100 mL 量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol·L-1NaOH溶液,倒入250 mL烧杯中,再用另一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
参考答案:D
本题解析:A不正确,因为过氧化钠要消耗水;B不正确,量筒不能稀释溶液;同样容量瓶也不能稀释溶液,C不正确,因此正确的答案选D。
本题难度:一般
5、选择题 质量为1g的H2O中含m个氢原子,则阿伏加德罗常数为( )
A.m/9
B.9m
C.2m
D.m
参考答案:B
本题解析:含有水的物质的量为1/18mol,含有氢原子的物质的量为1/9mol,含有的氢原子数为NA/9="m," NA=9m, 所以选B。
本题难度:一般