时间:2019-06-28 20:57:30
1、选择题 石墨作电极电解下列溶液,阴阳两极产生的气体体积比为2:1,且电解液pH增大的是
[? ]
A.KCl
B.NaOH
C.Na2SO4
D.H2SO4
参考答案:B
本题解析:
本题难度:一般
2、填空题 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
(1)X极与电源的?(填“正”或“负”)极相连,氢气从?(选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为?(填“阴离子”或“阳离子”,下同)交换膜,N为?交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为?。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是?,转移的电子数为?。
参考答案:(1)正 C (2)阴离子 阳离子 (3)H2-2e-+2OH-=2H2O (4)49g 6.02×1023
本题解析:题图中左边加入含硫酸的水,暗示左边制硫酸,即OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜。所以,C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-=4OH-,负极反应式为2H2-4e-+4OH-=4H2O。(4)n(H2)=0.5 mol,2H++2e-=H2↑,得电子为1 mol,X极的反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑,根据电子守恒知,生成H+的物质的量为1 mol,故生成0.5 mol H2SO4,m(H2SO4)=49 g。
本题难度:一般
3、填空题 如图是电解CuCl2溶液的装置图
(1)若c、d为石墨电极,推断a为电源的______极,c为电解池的______极,发生______反应,其电极反应为:______,d为______极,发生______?反应,其电极反应为:______;
(2)若c、d为铜电极,则在电解的过程中观察到的现象是c电极变______?(“粗”或“细”),d电极变______?(“粗”或“细”),溶液颜色______(“深”“浅”或“不变”).
参考答案:(1)由图可知,电流由正极流向负极,则a为正极,b为负极,c为阳极,d为阴极,阳极发生氧化反应,电极反应为2Cl--2e-=Cl2↑,
阴极发生还原反应,电极反应为Cu2++2e-=Cu,
故答案为:正;阳;氧化;2Cl--2e-=Cl2↑;阴;还原;Cu2++2e-=Cu;
(2)若c、d为铜电极,阳极发生Cu-+2e-=Cu2+,所以c电极变细,阴极发生Cu2++2e-=Cu,则d电极变粗,因电解质溶液的浓度不变,则颜色不变,
故答案为:细;粗;不变.
本题解析:
本题难度:一般
4、选择题 如图a、b、c、d均为石墨电极,通电进行电解。下列说法不正确的是? 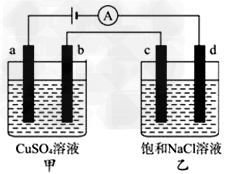
[? ]
A.甲中a电极反应式为4OH--4e-=O2↑+2H2O
B.当b极有64gCu析出时,c电极产生2g气体
C.电解后向乙中通入适量HCl气体,溶液组成可以恢复
D.电解时向乙中滴入酚酞试剂,d电极附近变红
参考答案:B
本题解析:
本题难度:一般
5、填空题 氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空: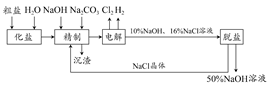
(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________________________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________。(选填a、b、c)。
a.Ba(OH)2?b.Ba(NO3)2?c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却________、(填写操作名称)除去NaCl。
参考答案:(1)2H++2e-=H2↑ 淀粉KI溶液
(2)Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)bc
(5)蒸发浓缩 过滤
本题解析:(1)电解NaCl溶液时,阴极发生还原反应2H++2e-=H2↑,阳极发生氧化反应2Cl--2e-=Cl2↑,Cl2的检验试剂为KI淀粉溶液,由于Cl2+2KI=I2+2KCl,I2遇淀粉变蓝色。
(2)Ca2+、Mg2+须转化为沉淀而除去。
(3)Ba2+也应转化成BaSO4以除去SO42-,但是除杂时过量的试剂不引入新杂质,b中NO3-作为新杂质不能采用。
(4)由于Ba2+过量时必须用CO32-除去,所以钡试剂必须在Na2CO3之前加入。
(5)NaCl为杂质,溶解度随温度变化小,应用冷却NaOH的热饱和溶液法除去。
本题难度:一般