时间:2019-06-28 20:46:30
1、选择题 将40克NaOH溶于水中,配制成1L溶液,则该溶液的物质的量浓度为
A.0.1mol/L
B.0.5mol/L
C.4mol/L
D.1mol/L
参考答案:D
本题解析:分析:根据溶质的质量计算溶质的物质的量,根据c=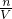 计算溶液的物质的量浓度.
计算溶液的物质的量浓度.
解答:n(NaOH)=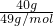 =1mol,
=1mol,
则c=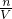 =
=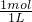 =1mol/L.
=1mol/L.
故选D.
点评:本题考查物质的量的有关计算,题目难度不大,注意物质的量与质量、浓度的计算公式的运用.
本题难度:简单
2、简答题 实验室需用CuSO4?5H2O体配制480mL0.1mol/L的CuSO4溶液,请回答下列问题:
(1)应用托盘天平称取CuSO4?5H2O晶体______g.
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的CuSO4?5H2O晶体是______g.
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、______、______.
(4)配制过程中有几个关键的步骤和操作如下图所示:将这些实验步骤A-F按实验过程先后次序排列______.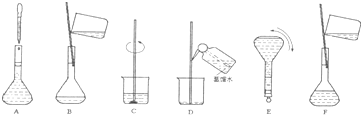
其中定容的具体操作是______.
(5)以下情况会使所配溶液的浓度产生何种影响(A.偏高?B.偏低?C.不变,填序号.):
①溶解晶体用的烧杯和玻璃棒未洗涤.______
②定容时俯视刻度线.______
③所用CuSO4?5H2O晶体已失去部分结晶水.______.
参考答案:(1)配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml容量瓶,CuSO4的物质的量n=cV=0.5L×0.1mol?L-1=0.05mol,CuSO4?5H2O的物质的量等于CuSO4的物质的量,所以CuSO4?5H2O的质量0.05mol×250g/mol=12.5g,故答案为:12.5;
(2)若药品与砝码放反,根据天平平衡原理m(左盘)=m(右盘)+游码读数,故实际称量硫酸铜晶体的质量为12g-0.5g=11.5g,故答案为:11.5;
(3)溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
所以还需要的仪器为:500mL容量瓶、药匙、胶头滴管,
故答案为:500mL容量瓶;药匙、胶头滴管;
(4)由(3)中溶液配制的一般步骤可知,正确的操作顺序为:CBDFAE,
其中定容的具体操作是:向容量瓶中加入蒸馏水,到液面离刻度线1~2cm处时,改用胶头滴管加蒸馏水至凹液面最低点与刻度线相切.
故答案为:CBDFAE;向容量瓶中加入蒸馏水,到液面离刻度线1~2cm处时,改用胶头滴管加蒸馏水至凹液面最低点与刻度线相切;
(5)①溶解晶体用的烧杯和玻璃棒未洗涤,少量硫酸铜沾在烧杯壁与玻璃棒上,移入容量瓶内硫酸铜的物质的量减少,所配溶液的浓度偏低,故答案为:B;
②定容时俯视刻度线,液面在刻度线下方,溶液的体积偏小,所配溶液的浓度偏高,故答案为:A;
③所用CuSO4?5H2O晶体已失去部分结晶水,硫酸铜的质量分数增大,实际称量的硫酸铜晶体中硫酸铜的质量偏大,所配溶液的浓度偏高,故答案为:A.
本题解析:
本题难度:一般
3、填空题 右图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL?1mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有______(写仪器名称);
(2)经计算,配制100mL 1mol?L-1的稀盐酸需要用量筒量取上述浓盐酸的体积为______mL,量取盐酸时应选用______mL(选填10mL、50mL、100mL)规格的量筒;
(3)对所配制的稀盐酸进行测定,发现其浓度大于1mol?L-1,请你分析配制过程中可能引起误差的原因(写出其中一个即可)______.
参考答案:(1)配制顺序是:计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用量筒(用到胶头滴管)量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:量筒、胶头滴管、烧杯、玻璃棒、100mL容量瓶,故答案为:100?mL的容量瓶、玻璃棒;
(2)设浓盐酸的体积为amL,则amL×1.18g/cm3×36.5%=1mol?L-1×0.1L×36.5g/mol,解得a=8.47,量筒的精确度为0.1mL,确定量取的体积为8.5?mL,选取10?mL规格的量筒,故答案为:8.5?mL;10?mL;
(3)因根据c=nV分析如果n偏大或V偏小,则所配制溶液浓度偏高,所以对所配制的稀盐酸进行测定,发现其浓度大于
1mol?L-1,
定容时,俯视容量瓶的刻度线或洗涤量取浓盐酸后的量筒,并将洗涤液转移至容量瓶中,
故答案为:定容时,俯视容量瓶的刻度线或洗涤量取浓盐酸后的量筒,并将洗涤液转移至容量瓶中.
本题解析:
本题难度:简单
4、填空题 实验室配制一定物质的量浓度的烧碱溶液,在下列各种情况下,所得溶液的物质的量浓度将如何变化(填“偏高”、“偏低”或“无影响”)
(1)在天平两托盘上分别垫上纸质、大小相同的两片纸,再将氢氧化钠固体放在纸上称量______.
(2)定容时,俯视观察刻度线______.
(3)在倒入氢氧化钠溶液前,容量瓶中有少量水,未经干燥______
(4)在容量瓶中加水至刻度线后,振荡,发现液体凹面低于刻度线,再用胶头滴管加蒸馏水至刻度线______.
(5)将配制好的溶液转移至刚洗净的试剂瓶______.
参考答案:(1)将氢氧化钠固体放在纸上称量,因氢氧化钠易潮解,吸水,所称氢氧化钠固体的质量偏小,物质的量偏小,浓度偏低,故答案为:偏低;
(2)定容时,俯视观察刻度线,溶液的体积偏小,浓度偏大,故答案为:偏高;
(3)容量瓶中有少量水,未经干燥,溶液的体积不变,无影响,故答案为:无影响;
(4)在容量瓶中加水至刻度线后,振荡,发现液体凹面低于刻度线,再用胶头滴管加蒸馏水至刻度线,由于刻度线滞留的溶液会下来,体积偏大,浓度偏小,故答案为:偏低;
(5)将配制好的溶液转移至刚洗净的试剂瓶,由于试剂瓶中有水对溶液进行了稀释,浓度偏低,故答案为:偏低.
本题解析:
本题难度:一般
5、选择题 下列实验操作能使实验结果偏低的是( )
A.用蒸馏水润湿的pH试纸所测定的某酸溶液的pH
B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线所配制的溶液浓度
C.用仰视量筒刻度量取的一定量浓硫酸所配制的0.1mol?L-1H2SO4溶液的浓度
D.用待测液润洗的锥形瓶进行中和滴定所测定的待测液浓度
参考答案:A、用蒸馏水润湿的pH试纸,相当于将酸液稀释,所测定的某酸溶液的pH偏高,故A错误;
B、容量瓶配制溶液,定容后摇匀液面下降再加水,相当于将所配溶液稀释了,实验结果偏低,故B正确;
C、用仰视量筒刻度量取的一定量浓硫酸,量取的浓硫酸体积偏大,所配制的0.1mol?L-1H2SO4溶液的浓度偏高,故C错误;
D、用待测液润洗的锥形瓶,相当于待测液量偏多,会使标准液加入偏多,根据c待=c标V标V待,V标变大,c待偏大,即待测液浓度偏大,故D错误.
故选B.
本题解析:
本题难度:一般