时间:2019-06-28 20:39:20
1、选择题 对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32
参考答案:
本题解析:
本题难度:一般
2、填空题 (14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知: 2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式 ;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1, c(H2)=0.3mol·L-1;
合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H< 0
2NH3(g) △H< 0
①计算在a达平衡时H2的转化率为 ;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是 ; 试写出判断b与a条件不同的理由 ;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) | 298 | 398 | 498 | …… |
| K | 4.1×106 | K1 | K2 | …… |
参考答案:(14分)
(1) 4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=-(2b+c-2a)kJ·mol-1(2分)
(或 4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=(2a-2b-c)kJ·mol-1等)
(2)①40%(2分)
②升高温度(1分);因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以b、a两条件下达到平衡时N2的浓度相同(或其他合理答案)(2分)
(3)<(1分);AC(2分)
(4)①NH4++H2O NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
②BC(2分)
本题解析:(1)由图1可知,1mol NO2和1mol CO反应生成CO2和NO的热化学方程式是CO(g)+NO2(g)=CO2(g)+NO(g) △H=-(b-a)kJ/mol,根据盖斯定律,将2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1与上式×2相加,可得CO将NO2还原至N2时的热化学方程式,为4CO(g)+2NO2(g)=4CO2(g)+N2(g) △H=-(2b+c-2a)kJ·mol-1;
(2)①在a达平衡时,氮气的浓度减小(0.1-0.06)mol/L=0.04mol/L,则氢气的浓度减小0.04mol/L×3=0.12mol/L,则平衡时 H2的转化率为0.12mol/L/0.3mol/L×100%=40%;
②由图2可知,曲线c达平衡时氮气的浓度增大且达平衡的时间缩短,说明反应速率加快,且平衡逆向移动,因为合成氨是放热反应,所以c改变的条件可能是升高温度,升高温度,平衡逆向移动,反应速率加快;而b达平衡时与a的氮气的浓度相同,达平衡的时间缩短,反应速率加快,说明平衡不移动,则b改变的条件是加入催化剂,所以b与a的条件不同;
(3)①合成氨是放热反应,温度升高,平衡逆向移动,平衡常数减小,所以K1<4.1× 106;
②A、达平衡时,各物质的浓度均保持不变,所以容器内NH3的浓度保持不变的状态是平衡状态,正确;B、根据化学方程式可知,达平衡时,3υ( N2)正= υ( H2)逆,错误;C、因为合成氨的反应是气体的物质的量发生改变的可逆反应,所以容器的体积固定时,压强不变的状态是平衡状态,正确;D、因为容器的体积不变,气体的总质量不变,所以气体的密度一直不变,所以气体的密度不变的状态不是平衡状态,错误,答案选AC;
(4)①NH4Cl溶液呈酸性的原因是因为铵根离子发生水解反应,使溶液中的氢离子浓度大于氢氧根离子的浓度,离子方程式是NH4++H2O NH3·H2O+H+;
NH3·H2O+H+;
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y =" 14," x > 11 )等体积混合后,则氨水溶液中的氢氧根
离子浓度等于硫酸中的氢离子浓度,因为氨水是弱碱溶液,所以等体积混合后,一水合氨过量,溶液
呈碱性,排除BD,得到的溶液为硫酸铵和一水合氨的混合液,则溶液中c(NH4+)>c(SO42-)>c(OH-)>c(H
+)成立;根据电荷守恒规律,有c(NH4+)+c(H+)=2c(SO42-)+c(OH-),c(SO42-)>0,所以c(NH4+)+c(H
+)>c(SO42-)+c(OH-),则答案选BC。
考点:考查盖斯定律的应用,热化学方程式的书写,溶液中离子浓度的判断,化学平衡移动的判断
本题难度:困难
3、选择题 常温下,用 0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L CH3COOH溶液所得滴定曲线如图。下列说法正确的是
CH3COOH溶液所得滴定曲线如图。下列说法正确的是
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
参考答案:D
本题解析:A、点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知: c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A错;
B、点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),故B错;
C、点③说明两溶液恰好完全反应生成CH3COONa,由于CH3COO-水解,且程度较小,所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错;
D、当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确,答案选D。
考点:考查NaOH与CH3COOH的反应中离子浓度比较以及滴定曲线的识别
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,注重答题的灵活性。该题难度较大,对学生的思维能力提出了较高的要求,涉及盐类的水解和溶液离子浓度的大小比较,注意利用电荷守恒的角度解答。
本题难度:困难
4、选择题 下列水解的离子方程式正确的是
[? ]
A.Fe3++3H2O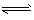 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Br-+H2O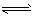 HBr+OH-
HBr+OH-
C.CO32-+H2O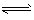 H2CO3+2OH-
H2CO3+2OH-
D.NH4++ H2O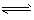 NH3·H2O +H+
NH3·H2O +H+
参考答案:D
本题解析:
本题难度:一般
5、选择题 25℃时,在20 mL 0.1 mol·L-1盐酸中逐滴加入0.2 mol·L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是
A.在b点,盐酸与氨水恰好完全中和
B.在b点:c(H+)=c(OH-),c(NH4+)=c(Cl-)
C.在a点:c(Cl-)> c(NH4+)> c(H+)> c(OH-)
D.在c点:c(NH4+)+ c(NH3·H2O)="2" c(Cl-)
参考答案:C
本题解析: A、在b点,氨水量多于盐酸,不能恰好完全中和,错误;B、呈中性,则溶液中必有c(H+)=c(OH-),根据电荷守恒c(NH4+)=c(Cl-),正确;C、在a点,氨水量等于盐酸,恰好完全中和生成氯化铵溶液,NH4+会部分水解,c(Cl-)> c(NH4+)> c(H+)> c(OH-),正确;D、形成等浓度的氨水和氯化铵的混合溶液,根据物料守恒:c(NH4+)+ c(NH3·H2O)="2" c(Cl-),正确。
考点:考查弱电解质,电解质溶液离子浓度、沉淀溶解平衡的综合应用等相关知识。
本题难度:困难