时间:2019-06-28 20:34:31
1、选择题 不能与溴水发生反应的是
①苯?②苯酚?③亚硫酸?④NaOH溶液?⑤AgNO3溶液?⑥裂化汽油?⑦己烷?⑧镁粉.
A.①
B.①⑦
C.①⑦⑧
D.①②⑤⑦
参考答案:B
本题解析:分析:溴具有氧化性,能与还原性物质发生氧化还原反应,能与有机物发生加成和取代反应,溶液呈酸性,能与活泼金属反应,能与碱溶液反应,以此解答该题.
解答:①溴与苯不发生反应;
②苯酚与溴水发生取代反应生成三溴苯酚;
③溴水能与亚硫酸发生氧化还原反应生成HBr和硫酸;
④溴水与NaOH溶液反应生成NaBr和NaBrO;
⑤溴水与硝酸银溶液反应生成AgBr沉淀,
⑥裂化汽油中含有不饱和烃,与溴水发生加成反应;
⑦己烷为饱和烃,不与溴水反应;
⑧溴水溶液呈酸性,与镁粉反应生成氢气.
不反应的为①⑦.
故选B.
点评:本题考查溴水的性质,题目难度不大,本题注意把握常见元素化合物的性质,注重相关基础知识的积累.
本题难度:简单
2、选择题 一定条件下,下列能发生置换反应生成铁的是
A.Zn+FeCl2(溶液)
B.Na+FeSO4(溶液)
C.Fe2O3+CO
D.Al+Fe2O3
参考答案:AD
本题解析:分析:A.锌的金属性比铁活泼,能置换出铁;
B.钠在溶液中先和水反应不能和硫酸亚铁反应;
C.三氧化二铁和一氧化碳反应生成铁和二氧化碳,但不是置换反应;
D.铝热反应是置换反应,能置换出铁;
解答:A.在金属活动顺序表中,锌的金属性大于铁,所以Zn+FeCl2=ZnCl2+Fe,符合置换反应一种单质和一种化合物生成另一种单质和另一种化合物的特征,故A正确;
B.钠与硫酸亚铁溶液反应,应为钠和水反应,2Na+2H2O=2NaOH+H2↑;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,得不到铁单质,故B错误;
C.三氧化二铁和一氧化碳反应,氧化铁失去氧生成铁发生了还原反应,一氧化碳得到氧生成二氧化碳发生了氧化反应,Fe2O3+3CO  2Fe+3CO2,反应物为两种化合物,不符合置换反应的定义,故C错误;
2Fe+3CO2,反应物为两种化合物,不符合置换反应的定义,故C错误;
D.氧化铁和铝粉在高温条件下发生铝热反应生成铁和氧化铝,反应的化学方程式为Fe2O3+2Al 2Fe+Al2O3,是置换反应,故D正确;
2Fe+Al2O3,是置换反应,故D正确;
故选AD.
点评:本题主要考查了置换反应相关方面的内容,熟记和理解一氧化碳还原氧化铁、铝热反应等反应的原理是解答的关键,题目较简单.
本题难度:简单
3、选择题 标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为7∶8
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
参考答案:C
本题解析:NO2溶于水的方程式是3NO2+H2O=2HNO+NO,所以根据体积差可知,参加反应的NO2是3.36L,所以原混合气中NO是1.12L,生成硝酸是0.1mol,浓度是1.0mol/L,反应中转移0.1mol电子。剩余气体是NO,氮元素和氧元素的质量之比是7︰8,所以选项AD正确,BC是错误的,答案选C。
本题难度:一般
4、选择题 将足量的氯气通入下列溶液中,溶质阴、阳离子的数目都明显改变的是
A.AgNO3
B.FeBr2
C.NaOH
D.Na2CO3
参考答案:B
本题解析:
本题难度:困难
5、选择题 取一定量可能含有Cu(NO3)2、AgNO3、KNO3三种物质中的一种或多种成分的粉末,加热后得到A气体aL,将气体用足量的水吸收,剩余气体B的体积为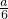 L.下列相关推测正确的是
L.下列相关推测正确的是
A.NO2与O2的体积比为5:1
B.气体B可能是NO2
C.NO2与O2的体积比为2:1
D.固体粉末的组成为n[Cu(NO3)2]:n(AgNO3):n(KNO3)=1:3:1
参考答案:CD
本题解析:分析:KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式如下:①2KNO3? 2KNO2+O2↑;
2KNO2+O2↑;
②2Cu(NO3)2 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
③2AgNO3 2Ag+2NO2↑+O2↑;
2Ag+2NO2↑+O2↑;
NO2与O2在水中反应的化学方程式如下:④4NO2+O2+2H2O═4HNO3,剩余气体可能为NO或O2,根据方程式讨论计算.
解答:KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式如下:①2KNO3? 2KNO2+O2↑;
2KNO2+O2↑;
②2Cu(NO3)2 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
③2AgNO3 2Ag+2NO2↑+O2↑;
2Ag+2NO2↑+O2↑;
NO2与O2在水中反应的化学方程式如下:④4NO2+O2+2H2O═4HNO3,剩余气体可能为NO或O2,
如剩余气体为O2,设反应的O2为xL,
4NO2+O2+2H2O═4HNO3
4? ?1
4x? x
则4x+x=a-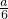 =
=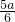 ,
,
x=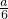 ,
,
NO2与O2的体积比为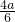 :
: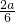 =2:1,
=2:1,
由反应的方程式可知,应满足:n[Cu(NO3)2]:n(KNO3)=1:1,n(AgNO3)可任意组成;
如剩余气体为NO,设反应的O2为yL,
3NO2+H2O═2HNO3+NO L?
L? 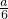 L
L
?4NO2+O2+2H2O═4HNO3
?4?1
?4y? y
5y=
y=0.1a,
则NO2与O2的体积比为(0.4a+ ):0.1a=9:1,
):0.1a=9:1,
但是根据这些固体加热产生的NO2和O2的比例来看,生成的NO2与O2物质的量之比为9:1是不可能的,
因此:剩余气体只能为O2,且NO2与O2的体积比为2:1,混合物应应满足:n[Cu(NO3)2]:n(KNO3)=1:1,n(AgNO3)可任意组成,
故选CD.
点评:本题考查混合物的计算,题目难度较大,解答时注意反应的化学方程式,判断分解产物的气体之间的体积关系,为解答该题的关键点,也是易错点.
本题难度:简单