时间:2019-06-28 20:29:39
1、简答题 某同学用10mol?L-1的浓盐酸配制250mL1mol?L-1的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要盐酸体积______mol.
(2)所需仪器除烧杯、量筒、玻璃棒外还需______、______.
(3)容量瓶上标有:a.温度、b.浓度、c.容量、d.压强、e.刻度线、f.酸式或碱式这六项中的______(填字母符号).
(4)下列操作引起所配溶液浓度偏低的是______
a.移液时洗涤烧杯2-3次,将洗涤液倒入容量瓶中
b.定溶时仰视液面
c.容量瓶未干燥
d.颠倒摇均后发现液面低于刻度线,再加水至刻度线
(5)取所配制的稀盐酸100mL与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为896mL,则参加反应的锌的质量为______设反应后溶液的体积仍为100mL,则反应后溶液中H+物质的量浓度是______.
参考答案:(1)溶液稀释前后溶液中溶质的物质的量保持不变,设需要盐酸体积为V,10mol?L-1?V=0.25L?1mol?L-1,解得V=0.025L=25mL,故答案为:25;
(2)配制一定物质的量浓度的溶液所需的仪器:烧杯、量筒、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(3)容量瓶上标有温度、容量、刻度线,故答案为:a、c、e;
(4)a.移液时洗涤烧杯2-3次,将洗涤液倒入容量瓶中,属于正确操作,故a错误;
b.定溶时仰视液面,所加水量会偏多,所配溶液浓度偏低,故b正确;
c.容量瓶未干燥,不会影响实验数据结果,故c错误;
d.颠倒摇均后发现液面低于刻度线,再加水至刻度线,相当于将溶液稀释,浓度会偏小,故d正确.
故选:b、d;
(5)根据反应:Zn+2H+=Zn2++H2↑,稀盐酸100mL的物质的量:0.1L×1mol/L=0.1mol,生成的氢气在标准状况下的体积为896mL,物质的量为:0.896L22.4L/mol=0.04mol,所以盐酸会剩余,消耗盐酸的物质的量为:0.08mol,消耗金属锌的物质的量为0.04mol,质量为:0.04mol×65g/mol=2.6g,剩余盐酸的物质的量为0.02ml,反应后溶液中H+物质的量浓度是0.02mol0.1L=0.2mol/L,故答案为:2.6g;?0.2?mol/L.
本题解析:
本题难度:一般
2、选择题 设NA表示阿伏加德罗常数,下列叙述中不正确的是
A.标准状况下,VL水含有的氧原子个数约为V/22.4NA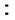
B.常温常压下,1mol 碳烯(CH2)所含的电子总数为8NA
C.标准状况下,含NA个氩原子的氩气体积约为22.4L
D.1mol OH-参与电解,提供的电子数目为NA个
参考答案:A
本题解析:略
本题难度:简单
3、选择题 用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.16. 9 g过氯化钡(BaO2)固体中阴、阳离子总数约为0. 2NA
B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA
C.a g某气体含分子数为b,c g该气体在标况下的体积为22. 4bc/ aNAL
D.某密闭容器盛有0. l molN2和0. 3 mol H2,在一定条件下充分反应,转移电子的数目为0. 6NA
参考答案:D
本题解析:A、16.9 gBaO2是0.1mol,阴阳离子为0.2 Na,正确;B、乙烯和环丁烷的最简式为CH2,28g混合气体可以看做为2mol(CH2),所以碳原子数为2 Na,正确;C、c g气体所含分子数为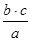 ,所以体积为22.4bc/ aNaL,正确;D、该反应为可逆反应,无法完全反应,错误。
,所以体积为22.4bc/ aNaL,正确;D、该反应为可逆反应,无法完全反应,错误。
本题难度:一般
4、选择题 NA表示阿伏加德罗常数的值,下列有关说法正确的是
A.标准状况下,22.4 LCH4和CH3CH2OH的混合物所含分子数为NA
B.常温常压下,16 g14CH4所含中子数目为8 NA
C.0.2 mol的Na2O2和水完全反应转移的电子数为0.2 NA
D.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
参考答案:C
本题解析: A.标准状况下CH3CH2OH是液体,不能使用气体摩尔体积,错误;B.常温常压下,16 g14CH4的物质的量小于1mol,所以所含中子数目小于8 NA,错误;C.0.2 mol的Na2O2和水完全反应转移的电子数为0.2 NA,错误;D.NH4NO3是强酸弱碱盐,在溶液中铵根离子会发生水解反应而消耗,所以0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目小于0.3NA,错误。
考点:考查阿伏加德罗常数的计算的知识。
本题难度:一般
5、简答题 实验室用98%的浓H2SO4(ρ=1.84g?cm-3)配制1.5mol?L-1稀H2SO4溶液100mL.
(1)计算所需浓H2SO4体积为______.
(2)量取所需浓H2SO4,应选用______.
(3)稀释浓H2SO4的方法(简要操作)______
(4)容量瓶使用前,检验其是否漏水的方法是______
以下操作会引起最后所配溶液的浓度发生什么变化,请填写(偏高、偏低、无影响)
(5)稀释后的浓H2SO4若立即转移至容量瓶中,所配溶液的浓度将______
(6)容量瓶用蒸馏洗涤后残留有少量的水______
(7)所用过的烧杯、玻璃棒未洗涤______?
(8)定容时俯视刻度线______?
参考答案:(1)浓硫酸的物质的量浓度为:c=1000ρwM=1000×1.84×98%98mol/L=18.4mol/L,
设需要浓硫酸的体积为V,则18.4mol/L×V=0.1L×1.5mol/L,解之得:V=0.0082L,即8.2ml,
故答案为:8.2ml;
(2)为减小误差,所用量筒和所量取的与液体的体积相近,应用10ml量筒,故答案为:10ml量筒;
(3)稀释浓硫酸时,为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,即将浓硫酸沿烧杯壁缓慢倒入水中,并用玻璃棒搅拌,
故答案为:将浓硫酸沿烧杯壁缓慢倒入水中,并用玻璃棒搅拌;
(4)容量瓶使用前,检验其是否漏水的方法是:在容量瓶中注入少量水,盖上瓶塞倒转观察,将瓶塞旋转1800再倒转观察,
故答案为:在容量瓶中注入少量水,盖上瓶塞倒转观察,将瓶塞旋转1800再倒转观察;
(5)稀释后的浓H2SO4若立即转移至容量瓶中,会使溶液温度偏高,溶液冷却后体积偏小,溶液浓度偏高,故答案为:偏高;
(6)容量瓶用蒸馏洗涤后残留有少量的水对实验结果无影响,故答案为:无影响;
(7)所用过的烧杯、玻璃棒未洗涤,会导致溶质的物质的量偏小,溶液浓度偏低,故答案为:偏低;
(8)定容时俯视刻度线会使溶液体积偏小,溶液浓度偏高,故答案为:偏高.
本题解析:
本题难度:一般