时间:2019-06-28 20:29:19
1、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是
[? ]
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.溶液中的c(CH3COOH)
D.溶液中的c(OH-)
参考答案:D
本题解析:
本题难度:一般
2、选择题 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如下图所示。下列说法正确的是[来源:91考试网ZXXK]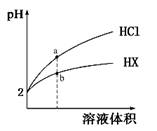
A.稀释前,c(HX)="0.01" mol/L
B.稀释10倍,HX溶液的pH=3
C.a、b两点:c(X-)>c(Cl-)
D.溶液的导电性:a>b
参考答案:C
本题解析:A、从稀释的图像分析,HX为弱酸,所以稀释前氢离子浓度为0.01mol/L,而酸的浓度要大于0.01mol/L,不选A;B、盐酸溶液稀释10倍,pH变为3,但HX为弱酸,促进电离,所以pH小于3,不选B;C、原来的溶液中由于氢离子浓度相同,两种阴离子浓度也相同,稀释相同倍数,弱酸电离程度增大,所以弱酸中阴离子浓度大,选C;D、b点溶液中离子浓度大,所以导电性强些,不选D。
考点:强弱电解质的稀释,pH的计算
本题难度:困难
3、选择题 在0.1mol?L-1 NH3?H2O溶液中存在如下电离平衡:NH3?H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
A.降低温度,溶液中c(NH4+)增大
B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小
C.加入少量0.1mol?L-1 HCl溶液,溶液中c(OH-)增大
D.加入水时,溶液中
| c(OH-) c(NH3?H2O) |
参考答案:A.一水合氨的电离是吸热反应,降低温度抑制其电离,则溶液中铵根离子浓度减小,故A错误;
B.向氨水中加入少量氢氧化钠,溶液中氢氧根离子浓度增大,则抑制一水合氨电离,温度不变,电离平衡常数不变,故B错误;
C.向氨水中加入少量浓盐酸,氢离子和氢氧根离子反应生成水,所以氢氧根离子浓度减小,故C错误;
D.加水稀释时,促进一水合氨电离,氢氧根 离子的物质的量增大,一水合氨的物质的量减小,所以溶液中氢氧根离子浓度与一水合氨分子浓度之比增大,故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 为了证明醋酸是弱电解质,甲、乙、丙、三人分别选用下列试剂进行实验:
0.1 mol·L-1醋酸溶液、pH=3的盐酸、pH=3的醋酸、、蒸馏水、锌粒、pH试纸等。
(1)甲取出10 mL0.1 mol·L-1醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是_________,理由是__________________________________。
(2)乙将pH=3醋酸和盐酸,各取1 mL,用蒸馏水稀来源:91考试网 www.91exAm.org释到100 mL,然后用pH试纸
分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是______________________________。
(3)丙分别取pH=3的盐酸和醋酸10 mL,然后分别加入质量相同的锌粒,醋酸放出H2的平均速率?(填“快”或“慢”),则认定醋酸是弱电解质,。
参考答案:(1) a>1?因为醋酸为弱酸部分电离?(2)盐酸的pH=5,醋酸的pH<5或醋酸在稀释过程中电离出H+,使PH变化小于盐酸。? (3)快
本题解析:醋酸是弱电解质,可测定一定浓度的pH、测定盐溶液的pH、醋酸的电离平衡移动、稀释时pH的变化等来分析;(1)测0.1 mol·L-1醋酸溶液的pH,若pH大于1,醋酸不能完全电离,则可证明醋酸为弱电解质;(2)pH=3醋酸和盐酸,各取1 mL,用蒸馏水稀释到100 mL,稀释100倍,测其pH,盐酸的pH变为5,若醋酸的pH<5,说明稀释促进醋酸电离,使H+浓度增大,证明醋酸溶液中存在电离平衡,为弱电解质;(3)当pH相同、体积相同时,盐酸完全电离,醋酸存在电离平衡,则分别加入足量锌,醋酸存在电离平衡向右移动,使得反应过程中醋酸中H+浓度大于盐酸,反应速率快。
本题难度:一般
5、选择题 常温时,将V1mL c1 mol/L的氨水滴加到 V2mL c2 mol/L 的盐酸中,则
小题1:若混合溶液的pH=7,则 c1V1?c2V2; c(NH4+) ??c(Cl-)(填>、=或<,下同)
小题2:若混合溶液的pH>7,则c1V1?c2V2; c(NH4+) ??c(Cl-)
小题3:若V1=V2、c1= c2,则混合溶液中离子浓度的大小关系为?。若此时溶液的pH=a,则由水电离出来的H+的浓度_________ mol·L-1,并写出下列算式的数学表达式: c(Cl-)—c(NH4+)=________________ mol·L-1
小题4:若V1=V2,且混合溶液的pH<7,则一定有c1< c2吗?请说明理由?。
参考答案:
小题1:? >? =
小题2:? >? >
小题3:c(Cl-)>c(NH4+)>c(H+)>c(OH-)? ;10-a?;?10-a-10a-14
小题4:不一定,c1= c2时,两者恰好反应生成NH4Cl溶液,pH<7,c1>c2时,pH也可能小于7。
本题解析:考查酸碱中和的有关计算以及溶液中离子浓度大小关系的比较。
小题1:氨水是弱碱,若氨水和盐酸恰好反应,生成物氯化铵水解,溶液显酸性。若溶液显中性,则说明氨水过量,即c1V1>c2V2。根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,当溶液显中性 即c(H+)=c(OH-)时,c(NH4+)=c(Cl-)。
小题2:若混合溶液的pH>7,则氨水仍然是过量的,即c1V1>c2V2。根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,此时c(NH4+)>c(Cl-)。
小题3:若V1=V2、c1= c2,则二者恰好反应,溶液中只有氯化铵,则混合溶液中离子浓度的大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。NH4+结合水电离出的OH-,促进水的电离,所以溶液中的氢离子就是水电离出的氢离子,即浓度为10-a mol/L。根据电荷守恒可知c(Cl-)-c(NH4+)=c(H+)-c(OH-)=10-a-10a-14 mol/L。
小题4:溶液显酸性,有可能水盐酸过量,也有可能水生成的氯化铵水解导致的。即使氨水过量,如果氯化铵的水解程度大于氨水的电离程度,溶液仍然会显酸性。例如:当c1= c2时,两者恰好反应生成NH4Cl溶液,pH<7。
本题难度:一般