时间:2019-06-28 20:26:36
1、选择题 下列有关溶液性质的叙述,正确的是
A.室温时饱和的二氧化碳水溶液,冷却到0℃时,会放出CO2气体
B.20℃,100g水可溶解34.2gKCl,此时KCl的饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压强的纯氧,100g水中溶入氧气的质量增加
参考答案:D
本题解析:分析:A、根据二氧化碳的溶解度随温度的变化分析;
B、根据w=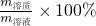 计算饱和溶液的质量分数;
计算饱和溶液的质量分数;
C、电解质的强弱与溶解度无关;
D、根据浓度增大,平衡向正方向移动分析;
解答:A、二氧化碳的溶解度随温度的升高二降低,所以室温时饱和的二氧化碳水溶液,冷却到00C时,不会放出CO2气体,故A错误;
B、w=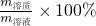 =
=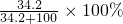 =25.5%,故B错误;
=25.5%,故B错误;
C、电解质的强弱与溶解度无关,硫酸钡难溶于水,但属于强电解质,故C错误;
D、因为空气溶入水的不仅有氧气,还有二氧化碳等其他气体,而换成纯氧,氧气浓度变大,促进氧气的溶解,所以溶入的氧气质量也增加,故D正确.
故选D.
点评:本题考查较为综合,涉及溶解度、质量分数、电解质以及平衡移动问题,本题易错点为D项,注意基础知识的积累.
本题难度:简单
2、选择题 100ml?0.1mol/L?Na2SO4溶液和100ml?0.1mol/L?BaCl2溶液混合后,Na+浓度约为
A.0.2mol/L
B.0.05mol/L
C.0.1mol/L
D.不能确定
参考答案:C
本题解析:分析:Na2SO4溶液中钠离子的浓度为0.2mol/L,混合后溶液的体积约为两溶液之和,根据稀释定律,混合前后钠离子的物质的量不变,据此计算混合后钠离子的浓度.
解答:0.1mol/L?Na2SO4溶液中钠离子的浓度为0.2mol/L.
混合后溶液的体积约为两溶液之和为100ml+100ml=200ml.
令混合后钠离子的浓度为c,根据稀释定律,混合前后钠离子的物质的量不变,则:
100ml×0.2mol/L=200ml×c.
解得:c=0.1mol/L.
故选C.
点评:本题考查物质的量浓度的有关计算,难度不大,可以利用定义式计算,注意基础知识的掌握.
本题难度:困难
3、选择题 下列物质中和乙酸一定不反应的是
A.Ba(OH)2
B.CaCO3
C.Na2SO4
D.CH3CH2OH
参考答案:C
本题解析:
本题难度:困难
4、选择题 某二价金属的碳酸盐和碳酸氢盐的混合物,跟足量的稀盐酸反应,消耗H+和生成的CO2的物质的量之比为5∶4,则该混合物中碳酸盐和碳酸氢盐的物质的量之比为
A.1∶1
B.1∶2
C.1∶3
D.2∶3
参考答案:D
本题解析:设二者分别为ACO3和A(HCO3)2的物质的量分别为a mol和b mol。由题意知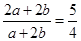 ,可推出a/b=2:3
,可推出a/b=2:3
本题难度:一般
5、选择题 在空气中长时间放置少量金属钠,最终的产物是
A.NaOH
B.Na2O
C.Na2CO3
D.Na2O2
参考答案:C
本题解析:分析:根据钠长期暴露在空气中,发生的一系列变化:切开金属钠置于空气中,切口开始呈银白色→变暗→变白色固体→成液→结块→最后变成Na2CO3粉末.
解答:切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3?10H2O)→最后变成Na2CO3粉(风化),有关反应如下:
4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3?10H2O、Na2CO3?10H2O=Na2CO3+10H2O.
故选:C.
点评:金属钠暴露在空气中发生的现象体现了钠及其化合物的性质,根据钠及其化合物的性质可以解释发生的现象.
本题难度:困难