时间:2019-06-28 20:26:16
1、填空题 (8分)现有浓度均为0.1 mol·L-1的下列溶液:①盐酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤硫酸氢铵 ⑥氨水,请回答下列问题:
(1)已知t ℃时,Kw=1×10-13,则t ℃(填“>”“<”或“=”)____________25 ℃。
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)_________。
(3)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号)__________________。
(4)常温下,将①和③按体积比2:1混合后,溶液的pH约为_______(已知lg3 = 0.5)。
参考答案:(1) > (2分) (2) ④②③ (2分)(3) ⑤④⑥ (2分) (4) 1.5 (2分)
本题解析:(1) 常温下水的离子积为Kw=1×10-14, t ℃时,Kw=1×10-13,说明水的电离受到了促进,所以是温度升高,则t ℃>25℃。(2)醋酸是弱酸,抑制水的电离;氢氧化钠是强碱会抑制水的电离,抑制的程度比醋酸更大,氯化铵是强酸弱碱盐,发生水解促进水的电离,故水电离出的H+浓度由大到小的顺序是④②③。(3)氯化铵中NH4+水解,NH4HSO4中HSO4-电离出来的H+会抑制NH4+的水解,所以NH4HSO4溶液中的NH4+浓度大于NH4Cl,由于氨水是弱碱电离出来的NH4+没有NH4Cl电离出来的浓度大。(4) 盐酸和氢氧化钠按体积比2:1混合后,盐酸过量,溶液显酸性,设体积为VL,则有c(H+)=(0.1×2V-0.1×V)÷3V="0.1/3" mol/L, pH="-lg" c(H+)="-lg" (0.1/3)=1.5
考点:水的电离平衡的移动、溶液中离子浓度的大小比较和pH的计算。
本题难度:一般
2、选择题 水的电离过程为H2O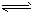 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
K(35℃)=2.1×10 -14。则下列叙述正确的是
[? ]
参考答案:D
本题解析:
本题难度:一般
3、选择题 PH=3和PH=5的盐酸等体积混合后溶液的PH是
A.3.3
B.3
C.5
D.4.7
参考答案:A
本题解析:PH=3的盐酸c(H+)=10-3mol/LPH=5的盐酸中c(H+)=10-5mol/L,等体积混合后
c(H+)=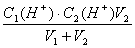 =
=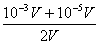 =5.05×10-4mol/lPH=-lg5.05×10-4=4-0.7=3.3,选A。
=5.05×10-4mol/lPH=-lg5.05×10-4=4-0.7=3.3,选A。
考点:考查PH值的计算。
本题难度:一般
4、选择题 下列电离方程式的书写正确的是
[? ]
A.NaHCO3===Na++H++CO32-
B.Al2(SO4)3===Al3++SO42-
C.H2SO4===2H++SO42-
D.NaHSO4===Na++HSO4-
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列措施能使水的电离程度增大的是
[? ? ]
A.加入盐酸溶液
B.加醋酸钠?
C.? 加入氨水?
D.?降温
参考答案:C
本题解析:
本题难度:简单