时间:2019-06-28 20:09:14
1、选择题 配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是(?)
A.容量瓶使用前有少量蒸馏水
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.在转移过程中有溶液撒在外面
D.俯视确定凹液面与刻度线相切
2、实验题 (7分)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2 mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0 g固体试剂,用500 mL容量瓶中配成待测液备用。
(2)将标准盐酸装在已经润洗过的25.00 mL酸式滴定管中,调节液面位置在?处,并 记下刻度。
记下刻度。
(3)取20.00 mL待测液,待测定。用甲基橙试剂作指示剂时,滴定到溶液颜色由?刚好至?色时为止。
(4)滴定达终点后,记下盐酸用去20.00 mL,计算NaOH的质量分数为?。
(5)试分析滴定误差可能由下列哪 些实验
些实验 操作引起的?。
操作引起的?。
A.转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量待测液溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读滴定管开始时仰视,读终点时俯视
3、实验题 [2012·云南省质检](10分)用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去)。称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解。实验前量气管起始读数为amL,实验后量气管的最终读数为bmL。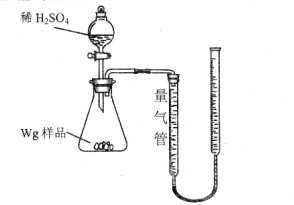
请回答下列问题:
(1)按上图完成装置连接,开始实验前必须进行的操作是?。
(2)写出锥形瓶中发生化合反应的离子方程式:??。
(3)实验结束后,锥形瓶内溶液中存在的金属离子有哪些可能?请根据选项进行填空(表格不一定填完):
A.盐酸
B.KSCN溶液
C.酸性KMnO4溶液
D.H2O2溶液
| 序号 | 溶液中可能存在 的金属离子 | 选择最少种数的试剂,验证该 假设(填字母) |
| ① | ? | ? |
| ② | ? | ? |
| ③ | ? | ? |
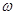 (Fe)? (b-a)×10-3L
(Fe)? (b-a)×10-3L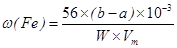
4、选择题 某同学想用实验证明FeCl3溶液显黄色不是氯离子造成的,下列实验无意义的是
A.观察KCl溶液没有颜色
B.向FeCl3溶液中滴加适量NaOH溶液,振荡静置,过滤后所得滤液黄色消失
C.向FeCl3溶液中滴加适量AgNO3溶液,振荡静置,过滤后所得滤液黄色未消失
D.加水稀释后FeCl3溶液黄色变浅
5、实验题 文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究。
(1)?提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有_____________。
(2)?设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及义器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧?杯、试管、胶头滴管。 
(3)?酸雨部分组成测定:
①?滴定:准确量取25.00mL该酸?雨于锥形瓶中,加入几滴淀粉溶液,将0.02000mol·L-1?碘水装入50mL酸式滴定管,滴定终点现象为__________,记录数据,重复滴定2次,平均消耗碘水VmL。
②?计算:被碘水氧化的物质的物质的量浓度之和为____________(只列出算式,不做运算)