时间:2019-06-28 20:05:46
1、选择题 以0.1000 mol·L-1 NaOH溶液滴定c mol·L-1,某弱酸HA溶液,其滴定曲线如图所示,下列说法正确的是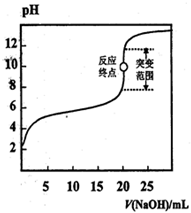
A.可用甲基橙作滴定指示剂
B.指示剂指示的滴定终点就是反应终点
C.突变范围的大小与酸的强弱及酸的浓度有关
D.滴定时氢氧化钠溶液盛放在带活塞的滴定管中
2、选择题 下列有关反应热的说法中正确的是(?)
A.一个化学反应是否能在常温下发生,与该反应的△H值的大小没有必然联系
B.中和热△H=-57.3kJ·mol-1,所以1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D.在101kPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量是CH4的燃烧热
3、选择题 ①pH=0的盐酸②0.5mol·L-1盐酸③0.1mol·L-1的NH4Cl溶液④0.1mol·L-1的NaOH溶液⑤0.5mol·L-1的NH4Cl溶液,以上溶液中水电离的c(H+)由大到小的顺序是(?)
A.⑤③④②①
B.①②③⑤④
C.①②③④⑤
D.⑤③④①②
4、选择题 在25℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是
A.V1=10V2
B.V1>10V2
C.V1<10V2
D.V2>10V1
5、选择题 常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(N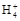 )=c(Cl-)
)=c(Cl-)
C.若混合液的pH=7,则混合液中c(N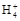 )>c(Cl-)
)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则一定有c1<c2