时间:2019-06-28 20:02:42
1、填空题 已知:J、L、M、R、T是原子序数依次增大的短周期主族元素;J元素最低负化合价的绝对值与其原子最外层电子数相等;L的最简单气态氢化物甲的水溶液显碱性;M是地壳中含量最多的金属元素;R形成简单的阴离子R2-与Ar的电子层结构相同.则
(1)M的离子电子式为______;
(2)元素T在周期表中的位置是______;
(3)用电子式表式JR2的形成过程______;
(4)M和T形成的化合物(MT3)在潮湿的空气中冒白色烟雾,反应的化学方程式为:______.(提示:此反应为非氧化还原反应).
(5)在微电子工业中,甲的水溶液可作刻蚀剂H2O2?的清除剂,所发生反应的产物不污染环境,其化学方程式为______.
2、选择题 下列化学用语表示正确的是( )
A.氯化钠的电子式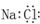
B.NaHCO3的电离方程式NaHCO3=Na++H++CO32-
C.乙醛的结构简式为CH3COH
D.氮气的结构式为N≡N
3、选择题 下列有关化学用语的说法中不正确的是
[? ]
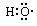 都表示羟基
都表示羟基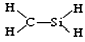

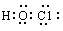
4、选择题 下列说法正确的是
[? ]
A.含有金属元素的化合物一定是离子化合物
B.IA族和ⅦA族原子化合时,一定生成离子键
C.完全由非金属元素形成的化合物可能是离子化合物
D.活泼金属与非金属化合时,一定能形成离子键
5、选择题 在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是
[? ]
A.N2? ?
B.PCl3? ? ?
C.BF3? ?
D.CO2