时间:2019-06-25 23:29:44
1、选择题 PM2. 5是指大气中直径小于或等于2.5微米的颗粒物,严重危害人体健康,也称为可入肺颗粒物。近年来我国PM2.5污染问题日益凸显。2013年长沙市开展PM2.5和臭氧监测,每天都公布空气质量级别。下面所列各项,在空气质量日报中完全正确的是(?)
①可吸入颗粒物?②总悬浮颗粒物?③氢氧化物?④二氧化碳?⑤二氧化硫
⑥二氧化氮?⑦一氧化碳?⑧一氧化氮?⑨氮气?⑩臭氧
A.①③⑤⑦⑨
B.②③⑤⑥⑦
C.②④⑥⑦⑩
D.①⑤⑥⑦⑩
参考答案:D
本题解析:①可吸入颗粒物是空气质量日报中的内容;正确;②总悬浮颗粒物不是空气质量日报中的内容; 错误; ③氢氧化物不是空气质量日报中的内容; 错误;④二氧化碳不是空气质量日报中的内容; 错误;⑤二氧化硫是空气质量日报中的内容;正确;⑥二氧化氮是空气质量日报中的内容;正确;⑦一氧化碳是空气质量日报中的内容;正确; ⑧一氧化氮是大气污染物,但是不是空气质量日报中的内容;错误;? ⑨氮气是空气的成分,表示污染物,错误;⑩臭氧是空气质量日报中的内容;正确;因此正确的说法是①⑤⑥⑦⑩,所以选项是D。
本题难度:一般
2、选择题 下列气体中,不会造成空气污染的是
A.N2
B.NO
C.NO2
D.CO
参考答案:A
本题解析:A.氮气为空气的主要成分,无毒,不会造成空气污染,故A正确;
B.NO有毒,排放在空气中,造成空气污染,故B错误;
C.NO2有毒,排放在空气中,造成空气污染,故C错误;
D.CO有毒,排放在空气中,造成空气污染,故D错误;
故选A.
本题难度:简单
3、填空题 (14分) CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。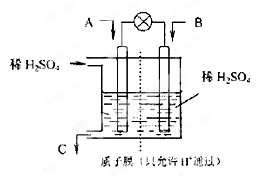
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的是??(填序号)
A.减少化石燃料的使用,开发新能源
B.使用无氟冰箱,减少氟利昂排放
C.多步行或乘公交车,少用私家车
D.将工业废气用碱液吸收后再排放
(2)有学者设想以右图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极的电极反应式为??;
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为?;
当电路中有1 mol e-流过,正极区溶液中的H+的物质的量的变化量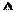 n(H+)=?mol。
n(H+)=?mol。
(3)在研究氮的氧化物的转化时,某小组查阅到以下数据:l7℃、l.01×l05Pa时,2NO2(g) N2O4(g)?△H<0的平衡常数K=13.3。
N2O4(g)?△H<0的平衡常数K=13.3。
①若该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol.L-1,
则c(N2O4)=?。(保留两位有效数字)
②若改变上述体系的某一个条件,达到新的平衡后,测得混合气体中c(NO2)="0.04" mol.L-1,c(N2O4)="0.007" mol.L-1,则改变的条件为 ?。
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。由CO和H2合成甲醇的方法是CO(g)+2H2(g) CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将?。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将?。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
参考答案:(1)ACD?(2)①CO2+6e-+6H+=CH3OH+2H2O
②SO2-2e-+2H2O=H2SO4+2H+?、1?(3)①0.012?②升高温度?(4)向逆反应方向移动
本题解析:(1)氟利昂主要是破坏臭氧层,所以正确的答案是ACD。
(2)原电池中负极失去电子,正极得到电子,所以①中CO2在正极通入,②中氧气得到电子,所以在负极通入的是SO2,电极反应式分别为①CO2+6e-+6H+=CH3OH+2H2O、②SO2-2e-+2H2O=H2SO4+2H+ 。②中正极反应式为O2+4e-+4H+=2H2O,所以当电路中有1 mol 电子流过时,正极区溶液中的H+的物质的量的变化量时1mol。
(3)①根据平衡常数的表达式可知c(N2O4)= c2(NO2)×K=(0.0300)2×13.3=0.012mol/L。
②当c(NO2)="0.04" mol.L-1,c(N2O4)="0.007" mol.L-1时,平衡常数等于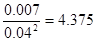 <13.3,这说明平衡向逆反应方向移动。应用反应是放热反应,所以是通过升高温度实现的。
<13.3,这说明平衡向逆反应方向移动。应用反应是放热反应,所以是通过升高温度实现的。
(4)此时三种物质的浓度分别为1mol/L、1.5mol/L和1mol/L,所以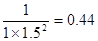 >0.27,所以反应是向逆反应方向移动的。
>0.27,所以反应是向逆反应方向移动的。
本题难度:简单
4、选择题 生活中常碰到某些问题,常涉及到化学知识,下列分析正确的是……( )
A.加酶洗衣粉是在洗衣粉中加入能使蛋白质水解的碱性蛋白质,为了不降低酶的活性,洗衣服时水
的温度越高越好
B.冬季为防止皮肤皴裂,可使用含水量30%左右的甘油护肤
C.SO2和Cl2均可用来漂白物质,二者同时使用会使它们的漂白效果明显增强
D.苯酚具有杀菌消毒作用,药皂中常常掺有少量苯酚,所以我们可以将苯酚直接涂抹在皮肤上起消
毒作用
参考答案:B
本题解析:本题可采用排除法快速得到答案。
A错。蛋白酶的最佳活性温度与人的体温一致,36℃--37℃,并非越高越好;
B正确。几乎在所有的护肤品中都能找到甘油的身影;
C错。Cl2+SO2+2H2O=H2SO4+2HCl,而HCl与H2SO4没有漂白性,因此混合使用漂白效果会降低;
D错。苯酚确实有杀菌消毒作用,但不能直接用于涂抹皮肤消毒,因为苯酚有毒。
本题难度:简单
5、填空题 (13分)化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)(2分)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:
?。
(2)(5分)现有一瓶胃舒平药片(复方氢氧化铝),请设计实验验证其主要成分。(写出实验步骤和实验现象):
将药片碾碎,?
?则说明其主要成分为氢氧化铝。
(3)(6分)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:__________________________________________? ______。
检验Fe3+常用的试剂除碱外,还可以用?(填化学式),现象是?。
参考答案:(13分)(1)HCO3- + H+ ="=" CO2 ↑+ H2O(2分)
(2)将药片碾碎,溶解在过量稀盐酸中,过滤,取滤液,逐滴加入氢氧化钠溶液,先出现白色沉淀,后沉淀溶解,则说明其主要成分为氢氧化铝。(5分, 答案合理均给分)
(3)2Fe2+ + Cl2 = 2Fe3++2Cl-? (2分,合理答案均给分);
KSCN? (2分);溶液变为血红色(2分)
本题解析:略
本题难度:一般