时间:2019-06-25 23:27:17
1、选择题 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是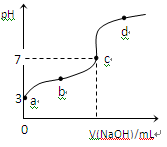
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液c(CH3COO-) > c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中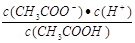 相等
相等
参考答案:C
本题解析:
答案C
恰好完全反应时,产物为CH3COONa,是强碱弱酸盐,水解后溶液呈碱性,pH>7
本题难度:一般
2、选择题 为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是
[? ]
A.适量盐酸
B.适量NaOH
C.适量KOH
D.适量KHS
参考答案:CD
本题解析:
本题难度:一般
3、选择题 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO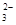 )、c(HCO3?)都减少,其方法是(?)
)、c(HCO3?)都减少,其方法是(?)
A.加入氢氧化钠固体
B.加水
C.通入二氧化碳气体
D.加入饱和石灰水溶液
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
A.pH=5的NaHSO3溶液中:c(HSO3—)>c(H2SO3)>c(SO32—)
B.使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH―)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=c(H2CO3)+c(H+)-c(OH-)
D.等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中:
c(Na+)=c(CH3COO-)+c(CH3COOH)
参考答案:BD
本题解析:NaHSO3溶液显酸性,说明电离程度大于水解程度,所以A不正确。使酚酞呈红色,说明溶液显碱性,因此苯酚钠的水解程度大于苯酚的电离程度,B正确。C不正确,不符合质子守恒。D正确,符合物料守恒,答案选BD。
本题难度:一般
5、选择题 现有浓度均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合。已知Mg(OH)2的Ksp=4.0×10—12,下列说法正确的是
A.混合前,氨水溶液中c(NH4+):c(OH—)=1:1
B.混合后c(NH4+):c(Cl—)=1:1
C.混合后c(Mg2+)×c(OH—)= 4.0×10—12
D.向混合后的分散系中加入FeCl3溶液,白色沉淀变红褐色
参考答案:D
本题解析:A、氨水中存在两个电离平衡:NH3?H2O  NH4++OH?、H2O
NH4++OH?、H2O  H++OH?,所以OH?的浓度大于NH4+的浓度,错误;B、均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合,生成Mg(OH)2和NH4Cl,因为NH4+水解,所以c(NH4+) < c(Cl—),错误;C、根据Ksp的含义,Ksp= c(Mg2+)×c(OH—)2= 4.0×10—12,错误;D、向混合后的分散系中加入FeCl3溶液,Mg(OH)2转化为更难溶的Fe(OH)3沉淀,所以白色沉淀变红褐色,正确。sp的含义与应用、电离平衡、盐类的水解。
H++OH?,所以OH?的浓度大于NH4+的浓度,错误;B、均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合,生成Mg(OH)2和NH4Cl,因为NH4+水解,所以c(NH4+) < c(Cl—),错误;C、根据Ksp的含义,Ksp= c(Mg2+)×c(OH—)2= 4.0×10—12,错误;D、向混合后的分散系中加入FeCl3溶液,Mg(OH)2转化为更难溶的Fe(OH)3沉淀,所以白色沉淀变红褐色,正确。sp的含义与应用、电离平衡、盐类的水解。
本题难度:一般