时间:2019-06-25 23:18:54
1、选择题 观察下列几个装置示意图,有关叙述正确的是( )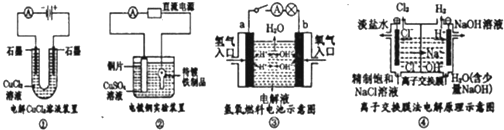
A.装置①中阳极上析出红色固体
B.装置②中铜片应与电源负极相连
C.装置③中外电路电流方向:b极→a极
D.装置④中阴极反应:2?Cl--2e-=Cl2
参考答案:A、电解氯化铜溶液时,阴极上铜离子得电子析出金属铜单质,故A错误;
B、电镀时,镀层应与电源正极相连,镀件与电源负极相连,所以铜做阳极,待镀铁制品应与电源负极相连,故B错误;
C、氢氧燃料电池中,负极上氢气失电子,正极上氧气得电子,所以装置③中闭合电键后外电路电子由a极流向b极,电路电流方向:b极→a极,故C正确;
D、所以装置④是电解池,阴极上氢离子得到电子生成氢气,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片
C.溶液中的阳离子向正极移动,阴离子向负极移动
D.电解液的PH值逐渐减少
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,则锌是负极,铜是正极,溶液中的氢离子在正极得到电子,因此选项C正确,A、B不正确,D不正确,溶液中的pH增大,D不正确,答案选C。
点评:该题是基础性试题的考查,也是高考中的常见题型和考点,有利于培养学生的逻辑推理能力。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
3、选择题 理论上不能设计为原电池的化学反应是(?)
A.CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H<0
B.HNO3(1)+NaOH(1)=NaNO3(1)+H2O(1);△H<0
C.2H2(g)+O2(g)=2H2O(1);△H<0
D.2FeCl3(1)+Fe(s)=3FeCl2(1);△H<0
参考答案:B
本题解析:A、为氧化还原反应,反应放热,可设计成原电池;B、为中和反应,不能设计成原电池;C、为氧化还原反应,反应放热,可设计成原电池;D、为氧化还原反应,反应放热,可设计成原电池。
本题难度:一般
4、选择题 铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示。下列说法正确的是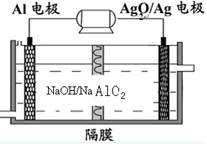
A.电池负极反应式2Ag+2OH--2e-=" Ag" 2O+H2O
B.放电时电池负极附近PH减小
C.电池总反应式2Al+3Ag2O+6H+ =2Al3++6Ag+3H2O
D.电解液中Na+通过隔膜由右向左移动
参考答案:B
本题解析:该装置是原电池,铝活泼作负极,电极反应为Al-3e-+4OH-═AlO2-+2H2O,AgO为正极,正极上的电极反应式为AgO+2e-+H2O═Ag+2OH-,故总反应为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O;放电时负极区消耗OH-,pH减小;负极区消耗OH-,正极生成OH-,故OH-从负极移向正极,该隔膜应为阴离子交换膜,Na+不能通过。
本题难度:一般
5、填空题 (海水电池)1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,则电源负极材料为:?,正极材料为:?。正、负极反应分别为:?、?。
参考答案:负极材料为:Al;正极材料为:石墨等能导电的惰性材料或活泼性比铝弱的金属材料。
负极反应:3Al-12e—=3Al3+
正极反应:3O2+6H2O+12e—=12OH-
本题解析:根据原电池构成的条件,活泼金属作负极(失去电子),发生氧化反应;惰性材料作正极(得到电子),发生还原反应。
本题难度:一般