时间:2019-06-25 23:18:54
1、实验题 (10分)某高二化学兴趣小组为了探究铝电极在原电池中的作用,设计并 进行了以下一系
进行了以下一系 列实验,实验结果记录如下:
列实验,实验结果记录如下:
(1)实验①、⑤中Al电极的作用是否相同 (填“是”或“否”);
(2)请在方框内画出实验③的原电池装置图,标出正、负极。
(3)实验②中电流计指针偏向 电极(填“Al”或“Cu”),Cu电极反应式为 ;
(4)实验④中铝为 极(填“正”或“负”),其电极反应式为 。
2、选择题 氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:
负极:2H2+4OH--4e- 4H2O
4H2O
正极:O2+2H2O+4e- 4OH-
4OH-
所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为( )
A.8.9×10-3 mol
B.4.5×10-2 mol
C.1.1×102 mol
D.5.6×10 mol
3、选择题 关于下图所示装置(盐桥含KCl)的叙述,正确的是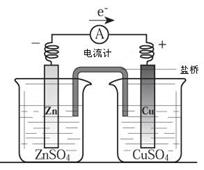
A.铜离子在铜片表面被氧化
B.铜作阳极,铜片上有气泡产生
C.电流从锌片经导线流向铜片
D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多
4、填空题 (9分)下图为Zn-Cu原电池的示意图,请回答:
(1)锌片为原电池的 (填“正”或“负”)极,该极的电极反应式是 。该反应属于 (填“氧化”或“还原”)反应。
(2) (填“电子”或“电流”)从锌片通过导线流向铜片,溶液中 的从 (填“锌片”或“铜片”)获得电子。
的从 (填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后, 溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
溶液的浓度(填“增大”或“减小”,下同),烧杯中溶液的质量 。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为 L(标准状况)。
5、选择题 有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应。据此,判断四种金属的活动性顺序是( )
A.A>B>D>C B.A>C>D>B C.C>A>B>D D.B>D>C>A