时间:2019-06-25 23:14:05
1、选择题 要使0.1mol/L CH3COOH溶液中CH3COOH的电离程度减小,同时又使CH3COO-浓度增大;可加入的试剂是
A.CH3COONa晶体
B.氨水
C.0.1mol/L H2SO4溶液
D.0.01mol/L CH3COOH溶液
参考答案:A
本题解析:醋酸部分电离产生CH3COO-和H+。加入CH3COONa晶体,增大了CH3COO-的浓度,使醋酸的电离平衡逆向移动,CH3COOH的电离程度减小,根据勒夏特列原理,CH3COO-的浓度增大了,故A对。加入氨水,消耗H+,H+浓度减小,平衡正向移动,CH3COOH的电离程度增大,CH3COO-浓度增大,B错。加入0.1mol/L H2SO4溶液,增大了H+浓度。平衡逆向移动,CH3COOH的电离程度减小,CH3COO-浓度也减小,C错。加入0.01mol/L CH3COOH溶液,降低了CH3COOH的浓度,CH3COOH的电离程度增大,CH3COO-浓度减小,D错。故选A
本题难度:一般
2、填空题 在一定温度下,无水醋酸加水稀释的过程中,溶液的导电能力,随加入水的体积V变化的曲线如图所示。 请回答:? 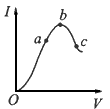
(1)“O”点导电能力为0的理由是___ 。
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为____。
(3)a、b、c三点处,电离程度最大的是___。
(4)若要使c点溶液中c(Ac-)增大,溶液c(H+)减小,可采取的措施是:①___,②___,③___。
参考答案:(1)在“O”点处醋酸未电离,无自由移动的离子存在
(2)c<a<b
(3)c
(4)加入NaOH固体 ;加入Na2 CO3固体 ;加入镁、锌等活泼金属
本题解析:
本题难度:一般
3、选择题 醋酸的下列性质中,可以证明它是弱电解质的是
[? ]
A.1mol / L醋酸溶液的pH约为2
B.醋酸能与水以任何比例互溶
C.10mL 1mol / L醋酸恰好与10mL 1mol / L NaOH溶液完全反应
D.在相同条件下,醋酸溶液的导电性比强酸溶液的弱
参考答案:AD
本题解析:
本题难度:一般
4、选择题 25℃时,在等体积的①ph=0的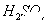 溶液、②0.05mol/L的
溶液、②0.05mol/L的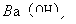 溶液、③ph=10的
溶液、③ph=10的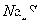 溶液、④pH=5的
溶液、④pH=5的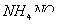 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是
A.1:10:10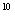 :10
:10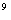
B.1:5:5 10
10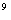 :5
:5 10
10
C.1:20:10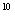 :10
:10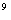
D.1:10:10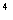 :10
:10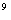
参考答案:A
本题解析:
正确答案:A
①中pH=0的H2SO4中c(H+)="1.0" mol·L-1,c(OH-)=1.0×10-14mol·L-1,水电离程度为1.0×10-14mol·L-1。②中c(OH-)="0.1" mol·L-1,c(H+)=1.0×10-13mol·L-1,水电离程度为1.0×10-13mol·L-1。③中c(OH-)=1.0×10-4mol·L-1,水的电离程度为1.0×10-4mol·L-1。④中c(H+)=1.0×10-5mol·L-1,水的电离程度为1.0×10-5mol·L-1。故①②③④中水的电离程度之比为:1.0×10-14mol·L-1:1.0×10-13mol·L-1:1.0×10-4mol·L-1:1.0×10-5mol·L-1=1:10:1010:109,A项正确。
本题难度:一般
5、选择题 0.1 mol·L-1盐酸分别跟20 mL NaOH和20 mL NH3·H2O反应,都消耗了20 mL 盐酸,这表明NaOH溶液和氨水的关系? (? )
A.物质的量浓度相同
B.氢氧根离子浓度相同
C.pH相同
D.溶液中离子浓度相同
参考答案:A
本题解析:略
本题难度:一般