时间:2019-06-25 23:10:17
1、选择题 下列物质属于强电解质的是(?)
A.CH3COOH
B.H2O
C.AgNO3
D.NH3·H2O
参考答案:C
本题解析:电解质是指:在水溶液中或熔融状态下能够导电的化合物。A选项, CH3COOH在水溶液中能部分电离出乙酸根离子和氢离子,能导电,是化合物,是弱电解质;B选项,水是化合物,能电离出氢离子和氢氧根离子,是弱电解质;C选项,AgNO3在水溶液中或熔融状态下能够电离出银离子和硝酸根离子,能导电,AgNO3是化合物,是强电解质;D选项,NH3?H2O在水溶液中能部分电离出氨根离子和氢氧根离子,能导电,是化合物,是弱电解质。
本题难度:简单
2、选择题 下列化学用语书写正确的是
A.少量Na2SO3溶液滴入NaClO溶液中离子方程式:H2O+2ClO-+SO═Cl2↑+SO+2OH-
B.氢氧燃料电池(KOH作电解质溶液)的正极反应式 2H2O+2e-═H2↑+2OH-
C.钢铁发生吸氧腐蚀的负极反应式:Fe-3e-═Fe3+
D.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO═CaCO3↓+H2O
参考答案:D
本题解析:分析:A.发生氧化还原反应生成硫酸钠、NaCl;
B.正极上氧气得电子;
C.Fe失去2个电子;
D.少量小苏打完全反应,反应生成碳酸钙、水、NaOH.
解答:A.少量Na2SO3溶液滴入NaClO溶液中离子方程式的离子反应为ClO-+SO32-═Cl-+SO42-,故A错误;
B.氢氧燃料电池(KOH作电解质溶液)的正极反应式为O2+2H2O+4e-═4OH-,故B错误;
C.钢铁发生吸氧腐蚀的负极反应式为Fe-2e-═Fe2+,故C错误;
D.澄清石灰水与少量小苏打溶液混合的离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答的关键,注意与量有关的离子反应及选项BC中的电极反应为解答的难点,题目难度中等.
本题难度:困难
3、选择题 下列反应的离子方程式不正确的是
A.醋酸加入氨水:CH3COOH+NH3?H2OCH3COO-+NH4++H2O
B.铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag
C.碳酸钙加入醋酸:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
D.硫氰化钾溶液加入三氯化铁溶液:Fe3++SCN-=[Fe(SCN)]2+
参考答案:BC
本题解析:分析:A、醋酸和氨水属于弱电解质,醋酸铵属于可溶于水的盐;
B、离子方程式中,反应前后要遵循电荷守恒;
C、碳酸钙是一种难溶于水的沉淀,不能拆成离子形式;
D、硫氰根和三价铁之间发生络合反应.
解答:A、弱酸和弱碱之间反应生成的盐是易溶于水的物质,只有盐可以拆成离子形式,故A正确;
B、离子方程式中,反应前后要遵循电荷守恒,应为:Cu+2Ag+=Cu2++2Ag,故B错误;
C、碳酸钙是一种难溶于水的沉淀,不能拆成离子形式,应为:CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+,故C错误;
D、硫氰根和三价铁之间发生络合反应,可以络合的硫氰酸根个数为1~6,故D正确.
故选BC.
点评:本题考查学生离子方程式书写的正误判断方法,是现在高考的热点考题.
本题难度:简单
4、选择题 能说明醋酸是弱电解质的事实是
[? ]
参考答案:D
本题解析:
本题难度:一般
5、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表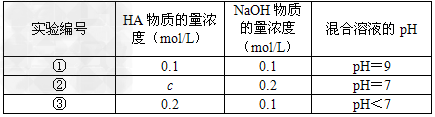
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?____________(填“强酸”或“弱酸”)
(2)②组情况表明,c____________0.2?mol/L(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是____________。
(3)从③组实验结果分析,说明HA的电离程度_________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是____________。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
参考答案:(1)弱酸
(2)大于;c(A-)=c(Na+)
(3)大于;c(A-)>c(Na+)>c(H+)>c(OH-)
(4)10-5
本题解析:
本题难度:一般