时间:2019-06-25 23:06:30
1、填空题 工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
已知:Cu2O + 2H+?=" Cu" + Cu2+ + H2O。
(1)滤液A中铁元素的可能存在形式为_______(填离子符号),与之相关的离子方程式为_____________,若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为_____________________________。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是_________(填代号)。
a.若用硫酸铜溶液作电解液,SO2- 4向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
参考答案:(12分)
Fe2+或Fe2+、Fe3+(2分);Fe2O3+6H+="2" Fe3++3H2O(2分)、2Fe3++Cu=2Fe2++ Cu2+(2分);
硫氰化钾溶液(其他合理答案同样给分)(2分)
(2)? 2Al+3CuO= Al2O3+3Cu(2分)
(3)? c(2分)
本题解析:Fe2O3、Al2O3、CuO、SiO2。SiO2与盐酸不反应,Fe2O3、Al2O3、Cu2O反应,Cu2O + 2H+?=" Cu" + Cu2+ + H2O、Fe2O3+6H+="2" Fe3++3H2O、Al2O3+6H+=2 Al3++3H2O,而2Fe3++Cu=2Fe2++ Cu2+,可分析出滤液A中的离子一定有H+、Cu2+、Al3+,可能有Fe2+(铜较多)或Fe2+、Fe3+(铜较少)。再加入足量NaOH生成固体Cu(OH)2和铁的氢氧化物,空气中灼烧转化为F(Fe2O3、CuO的混合物),滤液C为偏铝酸钠和NaOH的混合液,可提取金属E(为Al的单质)。
(1)可能有Fe2+(Cu2O较多)或Fe2+、Fe3+(Cu2O较少)。
(2)铝热反应2Al+3CuO= Al2O3+3Cu。
(3)电解法进行粗铜精炼时a.SO2- 4向阳极移动,错误。b.粗铜接电源正极,发生氧化反应,做阳极,错误。c.精铜作阴极,由于阳极铜和杂质金属放电,阴极只有Cu2+放电,所以电解后电解液中Cu2+浓度减小,正确。d.当粗铜消耗6.4 g时,由于阳极铜和杂质金属放电,失去电子不一定为0.2NA个,错误。
本题难度:一般
2、填空题 (10分)化学原理常应用于工业生产,如氯碱工业和硫酸工业:
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入? ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式____________________________________________________.
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式___________________________________________,
第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式___________________________________________________。
参考答案:(1)饱和食盐水(1分)? H2 NaOH (2分,缺一不可)
2NaCl? +? 2H2O ="=" 2NaOH + H2↑+Cl2↑(条件电解)(2分)
(2)沸腾炉(1分)? 2SO2+ O2 2SO3 (条件催化剂加热) 2分
2SO3 (条件催化剂加热) 2分
NaOH(aq)+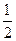 H2SO4(aq)===
H2SO4(aq)===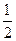 Na2SO4(aq)+H2O(l);ΔH=-2.5Q kJ·mol-1
Na2SO4(aq)+H2O(l);ΔH=-2.5Q kJ·mol-1
本题解析:略
本题难度:简单
3、填空题 下表列出了3种燃煤烟气脱硫方法的原理。
| 方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |

参考答案:(1)AC HCO3-+SO2=CO2+HSO3-
(2)S(g)+O2(g)=SO2(g)ΔH=-574.0 kJ·mol-1
(3)O2、SO2
本题解析:(1)增大氨水浓度,能反应掉较多的SO2,提高了SO2去除率;升高反应温度只能加快化学反应速率,且(NH4)2SO3、NH4HSO3受热易分解,又生成SO2;当SO2转化为NH4HSO3时,通入的空气才能将其氧化,空气不能直接氧化SO2,所以不能提高SO2去除率。
(2)根据盖斯定律,应用方程①-方程③得到
SO2(g)=S(g)+O2(g) ΔH=8.0 kJ·mol-1-(-566.0 kJ·mol-1)=574.0 kJ·mol-1,即S(g)+O2(g)=SO2(g) ΔH=-574.0 kJ·mol-1。也可用方程④-方程②求得。
(3)根据电解原理,NaHSO3溶液中的阴离子在阳极发生氧化反应,即4OH--4e-=2H2O+O2↑,又由于阳极区通入稀硫酸,H++HSO3-=H2O+SO2↑,所以阳极区的气体为O2、SO2。
本题难度:一般
4、填空题 【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: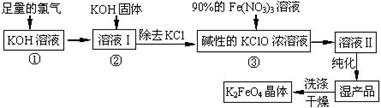
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
? 6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,还会有副产品 (写化学式),它们都是重要的化工 产?品,具体说出其中一种物质的用途 (答1点即可); 则反应③中发生的离子反应方程式为?。
(7)如何判断K2FeO4晶体已经洗涤干净?。
参考答案:(15分)
(1)温度较低?(1分)
(2)2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑(2分)
2NaOH + H2↑ + Cl2↑(2分)
(3)Fe元素的化合价显+6价,易得电子(1分)
(4)10 mol/L (2分)
(5)AC?(2分)
(6)KNO3 KCl, (2分)
KNO3可用于化肥,炸药等 (答1点即得1分)
2Fe3+ + 3ClO- + 10 OH-?= 2FeO42- + 3Cl-+ 5H2O?(2分)
(7)取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净。(2分)
本题解析:(1)该生产工艺反应①应在较低温度下进行,因为后面会用到KClO溶液;
(2)工业上制取Cl2,是通过电解饱和食盐水的方法,化学方程式为2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑;
2NaOH + H2↑ + Cl2↑;
(3)K2FeO4具有强氧化性的原因是Fe元素的化合价显+6价,易得电子,具有强氧化性;
(4)溶液的质量是100+61.6=161.6g,则溶液的体积为161.6g/1.47g/mL=110mL=0.11L,溶质的物质的量是61.6g/56g/mol=1.1mol,所以溶液的物质的量浓度为1.1mol/0.11L=10mol/L;
(5)反应①中通入过量的氯气,所以氯气有剩余,加入氢氧化钾固体与过量的氯气反应,生成更多的KClO,为下一步反应提供反应物;所以答案选AC;
(6)反应③中硝酸铁与次氯酸钾发生氧化还原反应,铁离子被氧化为FeO42- ,次氯酸根离子被还原为氯离子,所以从“反应液II”中分离出K2FeO4后,还会有副产品KNO3、KCl,其中KNO3可用于化肥,炸药等;根据分析,反应③中发生的离子反应方程式为2Fe3+ + 3ClO- + 10 OH-?= 2FeO42- + 3Cl-+ 5H2O;
(7)生成K2FeO4的同时还有氯化钾生成,所以判断K2FeO4晶体是否洗涤干净就是判断洗涤液中是否含有氯离子,判断方法是取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净。2FeO4晶体洗涤干净的方法
本题难度:一般
5、选择题 关于化工生产的下列叙述中,不正确的是(?)
A.工业生产硫酸时,使用热交换器可以充分利用反应热
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.电镀精炼铜时,纯铜与直流电源的负极相连
D.工业上金属Mg、Al都是用电解熔融的氯化物制得的
参考答案:D
本题解析:略
本题难度:简单