时间:2019-06-25 23:06:30
1、选择题 小明同学提出下列环保建议:
①用天然石材装修新房一定环保安全;
②提倡使用一次性发泡塑料餐具和塑料袋;
③开发生产无汞电池;
④提倡使用手帕,减少使用餐巾纸;
⑤开发无磷洗涤剂.
你认为其中可以采纳的是( )
A.全部
B.②④⑤
C.③④⑤
D.①③④⑤
参考答案:①天然石材中可能含有放射性元素,会对人体产生危害,所以用天然石材装修新房不一定环保安全,故错误;
②一次性发泡塑料餐具和塑料袋废弃物在自然界中难降解,所以使用一次性发泡塑料餐具和塑料袋会引起白色污染,故错误;
③含汞电池废弃物会引起土壤和水资源污染,所以开发生产无汞电池可以防止重金属离子污染,故正确;
④生成餐巾要消耗大量森林资源,所以减少使用餐巾纸,能节约资源,故正确;
⑤含大量磷元素的污水能引起水体富营养化,所以开发无磷洗涤剂,能防止水体污染,故正确;
所以可以采纳的是③④⑤.
故选C.
本题解析:
本题难度:一般
2、实验题 (16分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程: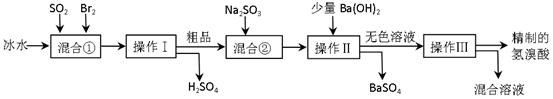
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为?。
(2)混合①中使用冰水的目的是?。
(3)操作Ⅱ和操作Ⅲ的名称分别是?、?。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体? b.固体和固体? c.互不相溶的液体? d.互溶的液体
(4)混合②中加入Na2SO3的目的是?。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为?,若假设成立可观察到的现象为?。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为?。
参考答案:
(1)SO2+Br2+2H2O → 2HBr+H2SO4。(3分)(2)降低体系温度,防止溴蒸发,使反应完全。(2分)
(3)过滤、蒸馏。d。(3分)
(4)除去粗品中未反应完的溴。(3分)
(5)KSCN溶液,溶液变成血红色。(3分)含有Br2,CCl4。(3分)
本题解析:略
本题难度:简单
3、填空题
⑴配平反应器中发生的反应方程式:
I2 + ?KIO3 + ?H2O="=" ?KH(IO3)2 + ?KCl + ?Cl2↑
⑵步骤②中,用硝酸而不用HI,其原因可能是?
⑶步骤③要保持溶液微沸1小时,以完全排出氯气,排出氯气的原因为?
?
⑷合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有?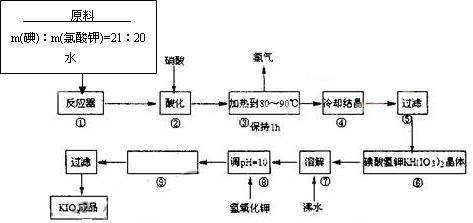
⑸用氢氧化钾调节溶液的PH值,发生的反应方程式为:
?
⑹参照碘酸钾溶解度曲线,步骤得到碘酸钾晶体,你建议的方法是?
| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 参考答案:(每空2分)(1)6,11,3=6,5,3;(2)HI具有还原性能将已生成的碘酸氢钾还原;(3)反应产生氯气跟KOH反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到KIO3。(4)漏斗、烧杯、玻璃棒;(5)KH(IO3)2 +KOH==2KIO3+H2O;(6)蒸发结晶。 本题解析:该题以KIO3制备实验为载体,考查了氧化还原反应及其方程式配平,过滤实验的仪器、物质的分离方法等。图、表结合,考查学生的阅读理解能力。(1)略(2)HI有较强还原性,IO3-有较强氧化性,二者发生反应:5I-+IO3-+6H+==3I2+3H2O,所以不能用HI酸化;(3)因为ClO-有强氧化性能将KIO3氧化成KIO4,故在加KOH之前要予以排除。(4)、(5)略(6)由表中数据可知KIO3在常温下的溶解度较小,又KIO3在650℃即分解,故最好采用蒸发浓缩溶液,让KIO3结晶析出再行过滤分离的方法。 本题难度:一般 4、选择题 下列叙述正确的是 参考答案:B 本题解析: 本题难度:简单 5、填空题 马格尼特法冶炼镁的工艺流程如下图。炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣。 参考答案: 本题解析: 本题难度:一般 |