时间:2019-06-25 22:47:17
1、选择题 在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后(?)
A.溶液为紫色
B.汽油层呈橙色
C.汽油层呈紫红色
D.溶液为橙色
参考答案:B
本题解析:氯水将溴化钾氧化为溴,然手被汽油萃取,故为橙色。
本题难度:一般
2、选择题 下列说法正确的是
A.在0.2L0.5mol/LAlCl3溶液中Al3+数目为0.1NA是Cl-数目的
B.标况下28gN2、CO混合气体中含有的原子数为2NA
C.31g白磷中含有NA个P-P键
D.电解饱和NaCl溶液时若共收集到22.4L气体(标况)则共转移电子2NA个
参考答案:B
本题解析:分析:A、依据铝离子在水溶液中能水解分析;
B、从N2和CO的摩尔质量相同,结合质量换算物质的量计算原子数;
C、依据白磷分子式是P4分析计算;
D、依据电解原理和电极反应计算;
解答:A、铝离子能水解,所以0.2L0.5mol/LAlCl3溶液中Al3+数目小于0.1NA,故A错误;
B、N2和CO的摩尔质量相同,都是双原子分子,28gN2、CO混合气体物质的量为1mol,含有原子数为2mol,故B正确;
C、白磷分子式为P4,31g白磷物质的量= =0.25mol,根据结构1mol白磷分子中含P-P共价键6mol,
=0.25mol,根据结构1mol白磷分子中含P-P共价键6mol,
所以0.25mol白磷含有P-P共价键1.5mol,故C错误;
D、电解饱和NaCl溶液时的电极反应;阳极:2Cl--2e-=Cl2↑? 阴极:2H++2e-=H2↑;电解过程中两个电极上的电子转移相同,所以得到Cl2~H2,共收集到22.4L气体(标况)则分别为11.2L即0.5mol,转移电子数0.5mol,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要是盐类水解应用,质量、摩尔质量的计算,电解原理的应用,电子转移数的计算应用,关键是白磷分子式和分子结构中的共价键的计算.
本题难度:一般
3、选择题 结合下图,分析下列叙述中,正确的是(? )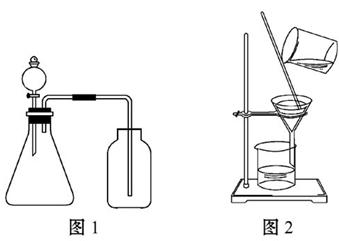
A.图1所示装置可用于分别制取少量NO和H2
B.图1所示装置可用于验证氧化性:KMnO4>Cl2
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.利用图2所示的方法可以提纯精制氢氧化铁胶体
参考答案:B
本题解析:制取NO和H2都可用固体与液体反应不加热得到,但收集H2不能用向上排空气法,收集NO不能用排空气法,A错误。利用浓盐酸与KMnO4反应得到氯气可证明氧化性KMnO4>Cl2,多余的Cl2可用NaOH溶液吸收,B正确。洗涤沉淀时,不能用玻璃棒在漏斗中搅拌,防止玻璃棒戳破滤纸,C错误。Fe(OH)3胶体可透过滤纸,不能用过滤法提纯精制,除去胶体中的电解质应使用渗析法,D错误。
本题难度:一般
4、选择题 下列常用实验仪器中,不能直接用于混合物的分离或提纯的是(?)
A.分液漏斗
B.容量瓶
C.蒸馏烧瓶
D.过滤漏斗
参考答案:B
本题解析:略
本题难度:简单
5、选择题 为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是
[? ]
参考答案:B
本题解析:
本题难度:一般