时间:2019-06-25 22:44:26
1、填空题 15、(4分) 一定温度下,A、B两瓶乙酸的浓度分别是1 mol/L和0.1 mol/L,则A、B两瓶乙酸溶液中[ H+ ]之比 10(填 “<”、“>”或“=”),并简述理由 。
参考答案:<; 乙酸为弱酸,电离为不完全电离,稀释促进电离。
本题解析:乙酸为弱酸,1mol/L变为0.1mol/L相当于被稀释,而稀释会促进电离,但乙酸的电离是不完全电离,所以A、B两瓶乙酸溶液中[ H+ ]之比<10。
考点:弱酸的电离
点评:注意酸的性质。
本题难度:一般
2、选择题 下列有关说法正确的是 ( )
A.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加
B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
参考答案:A
本题解析:A、根据△G=△H—T·△S可知,△G<0时反应自发。如果TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加,即△S>0,A正确;B、氯化钠是强酸强碱盐,不水解,溶液显中性。醋酸铵是弱酸弱碱盐,酸根离子与铵根离子水解程度相同,溶液显中性,但促进水的电离,B不正确;C、pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为弱碱,碱过量,溶液显碱性,C不正确;D、Na2CO3溶液中加入少量Ca(OH)2固体生成碳酸钙沉淀和氢氧化钠,CO32-水解程度减小,但溶液的碱性增强,pH增大,D不正确,答案选A。
考点:考查反应自发性、水的电离、盐类水解以及溶液酸碱性判断
本题难度:一般
3、选择题 相同温度相同物质的量浓度的六种溶液:按pH值由大到小的顺序是( )
①NaHCO3?②CH3COONa?③H3PO4?④Na2CO3?⑤NaHSO4.
A.③⑤②①④
B.③⑤①②④
C.④②①⑤③
D.④①②③⑤
参考答案:同温度相同物质的量浓度下列溶液中,
⑤NaHSO4为强酸的酸式盐,水溶液呈酸性;
③H3PO4为中强酸,水溶液呈酸性,但氢离子浓度小于硫酸氢钠溶液中的氢离子浓度,所以 磷酸溶液的pH值大于硫酸氢钠溶液的pH值.?
①NaHCO3、②CH3COONa、④Na2CO3?都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱水解程度越大,溶液中氢氧根离子浓度越大,PH越大,①②④对应酸根离子的水解程度大小为CH3COO-<HCO3-<CO32-,溶液PH由大到小的顺序
④①②③⑤,故选D.
本题解析:
本题难度:简单
4、填空题 (6分)在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为 。
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,
理由是 。
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是 。
参考答案:(1)中性 H++OH-=H2O(2)碱性 酸HA与碱MOH中和后,碱过量,还会电离出OH-
(3)酸性 M++H2O MOH+H+
MOH+H+
本题解析:(1)等浓度的一元强酸与一元强碱等体积混合,恰好反应生成强酸强碱盐,该盐溶液显中性,该反应的离子方程式为H++OH-=H2O;
(2)强酸电离出的H+浓度等于弱碱电离出的OH-,所以弱碱的浓度大于强酸,则等体积混合后溶液为强酸弱碱盐和弱碱的混合溶液,显碱性,原因是酸HA与碱MOH中和后,碱过量,还会电离出OH-;
(3)同浓度的一元强酸与一元弱碱等体积混合,恰好反应生成强酸弱碱盐,溶液呈酸性,出现这一现象的离子方程式M++H2O MOH+H+。
MOH+H+。
考点:考查溶液的酸碱性,溶液的PH,酸碱中和反应等知识。
本题难度:一般
5、选择题 下列叙述中,正确的是(?)
A.将0.l mol· 醋酸溶液加水稀释,溶液中所有离子的浓度都减小
醋酸溶液加水稀释,溶液中所有离子的浓度都减小
B.0.1 mol/L的一元弱酸HA加水稀释过程中,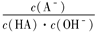 不变
不变
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.中和10 mL 0.1mol·L-1 醋酸与中和100 mL 0.01mol·L-1 的醋酸所需同种碱液的量不同
参考答案:B
本题解析:A项:c(OH-)是增大的,故错;C项:醋酸是弱电解质,部分电离,消耗的多,故错;D项:酸的物质的量相同,所需的碱也是相同的,故错。故选B。
点评:本题考查学生弱电解质的电离的相关知识知识,可以根据教材知识来回答,难度不大。
本题难度:简单