时间:2019-06-25 22:41:01
1、推断题 下列物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为深棕红色极易挥发液体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。 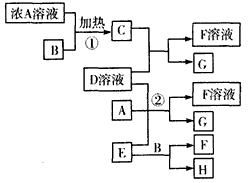
请回答下列问题:
(1)反应①的化学方程式为____________________。
(2)反应②的离子方程式为____________________。如果有16gG生成,反应过程中转移电子的物质的量是_______mol。
(3)写出另外一种实验室制取H的化学方程式:______________________。
(4)工业制硫酸的关键反应是用H与大气污染物之一的气体物质反应,其反应的化学方程式是___________________,该反应的平衡常数表达式是___________。
(5)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=6.60×10-6。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mol/L,则生成沉淀所需Pb(NO3)2溶液的最小浓度为_____________。
2、实验题 (14分)利用过滤的方法可以初步除去粗盐中的泥沙等不溶性的杂质,但仍含有CaCl2,CaCl2是一种易溶于水的物质,无法用过滤的方式将其和NaCl分离,经过分析讨论,某小组同学在此基础上继续设计了如下实验:
回答下列问题:?
(1)该小组同学的实验目的是?;(3分)
(2)上图括号内的操作步骤 为①?②?;(4分)
为①?②?;(4分)
(3)按此实验方案得到的NaCl固体中肯定含有?(填化学式)杂质,为了解决这个问题可以向过滤得到的滤液中加入适量的?(填名称)。(4分)
(4)写出上述实验中加入过量Na2CO3后发生反应的化学方程式?。 (3分)
(3分)
3、推断题 A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均己给出。
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为第ⅦA族元素单质。则A、D、E的氧化性由强到弱的顺序为(用化学式表示)________________________。
(2)若B是某元素R的氢化物,B的沸点大于与R同主族的其他元素氢化物的沸点,且B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应①的化学方程式________________________________________,③的化学方程式_____________________________。
(3)若B由短周期元素X、Y组成,且X、Y原子个数比为1∶1,B晶体中既含离子键,又含非极性共价键;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,反应①的离子方程式______________________________。
4、填空题 (10分)下图中的反应①是重要的电化学工业反应,反应②可用于制备新型消毒净水剂Na2FeO4。常温下B、C为气态单质,G是当代社会使用量最大的金属,其余均为化合物。(反应时加入或生成的水,以及生成沉淀I时的其他产物均已略去) 。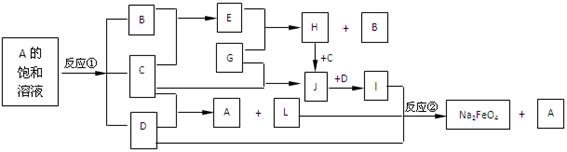
请回答下列问题:
(1)L的电子式为_______________。
(2)J溶液蒸干灼烧得到的物质是(填化学式) _______________。
(3)反应①的化学方程式是____________________________________。
(4)反应②的离子方程式是____________________________________。
(5)Na2FeO4能起到消毒净水的原理是?。(用文字叙述)?
5、实验题 聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。
,广泛用于污水处理。
某化学兴趣小组在实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、Si02等)
制备聚铁和绿矾 的过程如下:
的过程如下: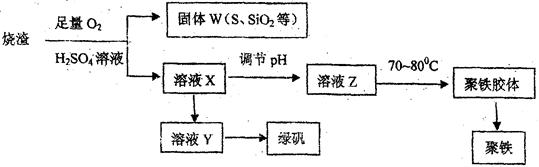
(1) 验证固体W焙烧后产生的气体含有SO2的方法是?。
(2) 实验室制各、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各
仪器接口,顺序为a→?→?→?→?→f,装置D的作用是?,装置E中NaOH溶液的作用是?。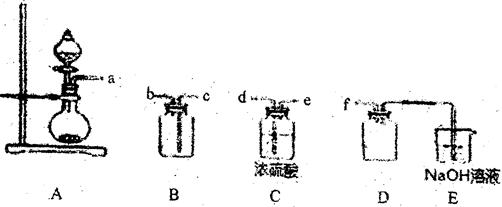
(3) 制备绿矾时,内溶液X中加入过量?,充分反应后,经?
操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用PH试纸测定溶渡pH的操作方法为?
?。