时间:2019-06-25 22:28:08
1、选择题 已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是?
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
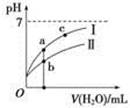
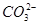
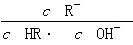 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)2、填空题 (12分)现有①0.2 mol/L NaOH溶液 ②0.2 mol/LHX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)?②中由水电离出的c(H+)(填“>”、“<”或“来源:91考试网 91ExaM.org=”)。
(2)上述混合液中共存在?种粒子,且c(HX)?c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-)?0.1 mol/L(忽略体积变化)。
(3)上述混合液显?性(填“酸”、“碱”或“中”),其原因用离子方程式表示为?。
3、选择题 0.1mol/L某一元弱酸水溶液,在100℃和20℃时相比,其C(H+)前者比后者? (? )
A.大
B.小
C.相等
D.不能肯定
4、选择题 甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示: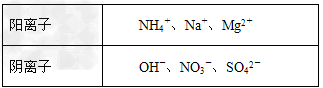
取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是
[? ]
①MgSO4?②NaOH?③(NH4)2SO4?④Mg(NO3)2?⑤NH4NO3
A.①②?
B.③④?
C.③⑤?
D.①⑤
5、实验题 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________________和______________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸溶液浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |