时间:2019-06-25 22:22:57
1、选择题 将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是?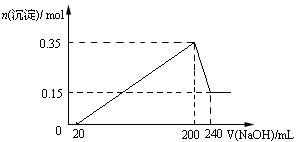
A.Mg和Al的总质量为9g
B.最初20mLNaOH溶液用于中和过量的稀硫酸
C.NaOH溶液物质的量浓度为5mol·L-1
D.生成的氢气在标准状况下的体积为11.2L
参考答案:D
本题解析:试题分析:根据图像可知,加入氢氧化钠溶液后并没有立即生成沉淀,这说明稀硫酸是过量的,所以应该有关的方程式是H++OH-=H2O、Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓、Al(OH)3+OH-=AlO2-+2H2O。根据图像可知,和氢氧化铝反应的氢氧化钠溶液是240ml-200ml=40ml,则氢氧化铝的物质的量是0.35mol-0.15mol=0.20mol,氢氧化镁是0.15mol,所以根据原子守恒可知,镁和铝的总的质量是0.15mol×24g/mol+0.2mol×27g/mol=9g;氢氧化钠溶液的物质的量浓度是0.2mol÷0.04L=5mol/L。生成的氢气在标准状况下的体积为(0.15mol+0.3mol)×22.4L/mol=10.08L,所以选项D是错误的,答案选D。
考点:考查镁、铝和酸碱反应的有关计算
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是明确反应原理,然后依据方程式和图像灵活运用即可。
本题难度:一般
2、选择题 下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别的是
A.NaOH、CuSO4、HCl、KNO3
B.HCl、KOH、NaCl、Na2SO4
C.Ca(OH)2、Na2CO3、NaCl、HCl
D.NaNO3、MgCl2、KCl、Ba(OH)2
参考答案:C
本题解析:铜离子在溶液中显蓝色,所以A中只能鉴别出NaOH、CuSO4;B中盐酸和氢氧化钠分液没有现象,无法鉴别,B不正确;由于碳酸钠能和氢氧化钙反应产生白色沉淀,且碳酸钠和盐酸反应是分别进行的,所以选项C能鉴别;D中氯化镁和氢氧化钡反应生成白色沉淀,所以只能把物质分成2组,无法进一步鉴别,答案选C。
本题难度:一般
3、选择题 除去Na2CO3?固体中少量NaHCO3的最佳方法是
[? ]
A.加入适量盐酸
B.加入NaOH溶液
C.加热
D.配成溶液后通入CO2
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+, 不含有Mg2+
参考答案:C
本题解析:A不正确,不能排除是否含有亚铁离子;B不正确,也可能含有铁离子;D不正确,不能排除镁离子,因为生成的白色沉淀氢氧化镁被红褐色掩盖,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点之一。试题基础性强,操作对学生实验能力的培养和训练,有利于培养学生的严谨的逻辑思维能力。该题需要明确的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般
5、填空题 某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质:
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备。
对该实验分析正确的是
A.金属A、B、C分别为Ag、Fe、Al
B.g、f都为氧化物,工业上均采用电解g与f获得对应金属单质
C.沉淀b为混合物,主要成分为沉淀d和沉淀e
D.甲是氢氧化钠,丁为稀硫酸
参考答案:C
本题解析:根据所给的试剂和流程图可以得出:

又图可知,C正确。
本题难度:一般