时间:2019-06-25 22:17:27
1、选择题 下列事实中,不能用勒夏特列原理解释的是
A.密闭、低温是存放氨水的必要条件
B.实验室常用排饱和食盐水法收集氯气
C.硝酸工业生产中,使用过量空气以提高NH3的利用率
D.合成氨反应采用较高温度和使用催化剂,以提高氨气的产量
参考答案:D
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系。A、温度越低,气体的溶解度越大,物质分解的速率越小,所以密闭、低温是存放氨水的必要条件可以用勒夏特列原理解释,A不符合题意;B、氯气溶于水生成氯化氢和次氯酸,饱和食盐水中氯离子浓度大,可以抑制氯气的溶解,则实验室常用排饱和食盐水法收集氯气可以用勒夏特列原理解释,B不符合题意;C、硝酸工业生产中,使用过量空气,增大氧气的浓度促使平衡向正反应方向移动,所以提高NH3的利用率,可以用勒夏特列原理解释,C不符合题意;D、催化剂不能改变平衡状态,只能改变反应速率。合成氨是放热反应,低温有利于氨气的生成。所以合成氨反应采用较高温度和使用催化剂,以提高氨气的产量不能用勒夏特列原理解释,D正确,答案选D。
本题难度:一般
2、填空题 (7分)在如图所示的三个容积相同的三个容器①、②、③中进行如下的反应:
3A(g) + B(g) 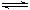 ?2C(g);△H<0
?2C(g);△H<0
(1)若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号)?;
(2)若维持温度不变,起始时② 、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度②?③(填<、>、=);
、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度②?③(填<、>、=);
(3)在②中投入3 mol A和1 mol B达平衡;若在相同条件下,起始时在②中投入a mol A和b mol B及c mol C,使两种情况达平衡时容器内C的百分含量相等,则a、b、c的关系为?。
参考答案: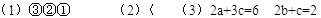
本题解析:略
本题难度:一般
3、选择题 将1mol 和1mol
和1mol 充入某固定容积的反应器中,在一定条件下,
充入某固定容积的反应器中,在一定条件下, +
+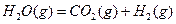 达到一定反应限度时有2/3的
达到一定反应限度时有2/3的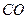 转化成
转化成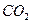 ,在相同条件下,将1mol
,在相同条件下,将1mol 和2mol
和2mol 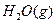 充入同一反应器中,当反应达到同一反应限度混合气体
充入同一反应器中,当反应达到同一反应限度混合气体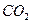 的体积分数可能是
的体积分数可能是
A.22.2%
B.28.2%
C.33.3%
D.37.8%
参考答案:B
本题解析:本题考查化学平衡计算;根据三段式:将1molCO和1molH2O充分反应达到平衡时:
CO? + H2O ="?" CO2 +? H2
开始:1mol? 1mol? 0? 0
转化:?
平衡:?
平衡时CO2的体积分数为:×100%=33.3%
若充入1molCO和2molH2O充分反应达到平衡时,假设有的CO转化为CO2:
CO? + H2O ="?" CO2 +? H2
开始:1mol? 2mol? 0? 0
转化:?
平衡:?
平衡时CO2的体积分数为:×100%=22.2%
由于反应中充入的H2的量增加,故CO的转化率增大,因此CO2的体积分数大于22.2%,而小于33.3%,B项符合题意。
本题难度:简单
4、填空题 (9分)在一定温度下, 把2molN2和6molH2通入体积不变的容器中。容器中发生以下反应: N2(g) + 3H2(g) 2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
保持上述反应温度不变, 设a.b.c分别代表起始加入的N2.H2和NH3的物质的量。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同, 那么:
(1)若a = 1.c =" 2," 则b =?。在此情况下, 反应起始时将向?方向进行(填“正”或“逆”)。
(2)若需规定起始时反应向逆方向进行,则c的范围是?。
参考答案:(1)3 ,?逆 ,
(2)1<c≤4
本题解析:? N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
起始(mol) 2? 6
转化(mol) x? 3x? 2x
平衡(mol)2-x? 6-3x? 2x
8-2x=7,x=0.5mol。
(1)? N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
平衡(mol)? 1.5? 4.5? 1
某时刻(mol)1? b ?2
根据以上数据知b=3,因为反应物的量小于平衡量,说明反应向逆反应进行。
(2)向逆向移动,则氨气的量必须大于平衡量1mol,同时不能高于最大值4mol,范围是1<c≤4。
点评:利用三行式可以快速解决化学平衡计算。
本题难度:一般
5、选择题  2Z
2Z
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)==2v逆(Y)
C.达到平衡后,降低温度,正向反应速率减小的倍数小于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方法移动
参考答案:AC
本题解析:平衡常数越大,说明正反应进行的越彻底,反应物的转化率就越大,故A正确;化学反应速率之比等于它们的化学计量数之比,故v逆(Z)=2v逆(X),很明显正逆反应速率不相等,故B不对;达到平衡后,降低温度,平衡向放热反应方向(则正反应方向)移动,说明正反应的速率大于逆反应的速率,即正反就速率减少的要小,所以C正确;,升高温度,平衡向吸热反应方向(则逆反应方向)移动,而增大压强,平衡向气体体积减少的方向移动,而这个反应是个气体体积不变的反应,所以改变压强对平衡无影响。故D也不对。
本题难度:一般