时间:2019-06-25 22:10:30
1、选择题 “绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是? 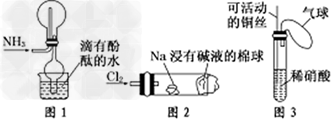
[?]
①实验室收集氨气采用图1所示装置? ②实验室中做氯气与钠反应实验时采用图2所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验? ④实验室中采用图3所示装置进行铜与稀硝酸的反应? ?
A.②③④?
B.①②③? ?
C.①②④?
D.①③④
2、选择题 下列各项中,现在提倡的是
[? ]
①原子经济 ②绿色化学 ③液体饮料中加少量三聚氰胺 ④研发新型环保汽车
A.①②
B.③④
C.①②④
D.①②③④
3、选择题 下列制取硫酸铜的实验设计中,能体现“经济、高效、环保”精神的最佳方案是
[? ]
A.铜与浓硫酸共热
B.用铜片为阳极,石墨为阴极,电解稀硫酸
C.先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解
D.适当温度下,使铜片在持续通入空气的稀硫酸中溶解
4、选择题 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器接触室(见图)。按此密闭体系中气体的流向,则在A处流出的气体为(? )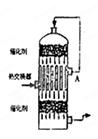
A.SO2
B.SO3、O2
C.SO2、SO3
D.SO2、O2
5、填空题 金属钛被称为铁和铝之后崛起的第三金属,它是空间技术、航海、化工、医疗上不可缺少的材料。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的离子方程式?。
II、为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。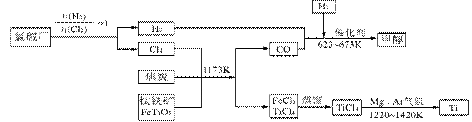
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________________________。
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=一641 kJ·mol-1
②1/2Ti(s)+Cl2(g)=1/2TiCl4(l);△H=一385 kJ·mol-1
则Mg 与TiCl4反应的热化学方程式为?,
该反应在氩气氛中进行的理由是?。
(5)在上述产业链中,合成192 t 甲醇理论上需额外补充H2?t (不考虑生产过程中物质的任何损失)。