时间:2019-06-25 21:56:00
1、计算题 (6分) 铁粉和氧化亚铁粉末的混合物共9.2克,加入到150mL的稀硫酸中,恰好完全反应,得到氢气2.24L(标准状况)。求:
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
参考答案:⑴ Fe:5.6g? FeO:3.6g? 3分?⑵ 1? mol/L? ? 3分
本题解析:n=V/Vm=0.1mol
Fe+H2SO4==FeSO4+H2 ↑
1? 1
n Fe? 0.1mol
所以n Fe="0.1" mol,mFe=5.6g,? mFeo=9.2g-5.6g=3.6g,? nFeo=0.05mol
溶质为硫酸亚铁,根据铁元素守恒n FeSO4=0.15mol,所以n H2SO4=0.15mol,C H2SO4=1? mol/L
本题难度:一般
2、选择题 下列物质在常温下可用铁质容器盛放的是
A.亚硫酸
B.浓硫酸
C.浓盐酸
D.胆矾溶液
参考答案:B
本题解析:略
本题难度:简单
3、选择题 有关物质的转化关系如下图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色。下列有关判断正确的是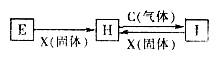
A. X固体可能是碘单质
B. 图中所示反应均为氧化还原反应
C. 1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数)
D. E、H、I溶液配制时,均需加酸防止其水解
参考答案:B
本题解析:H溶液呈浅绿色含亚铁离子,I溶液呈棕黄色含Fe3+,X固体为还原剂,而碘单质无法将Fe3+还原为Fe2+,故A错误;C气体为强氧化性气体,1mol C与H溶液完全反应转移电子数不一定为NA,若为氯气则为2NA,故C错误;E可能为稀的强酸溶液如盐酸,则无需防止其水解,D错误;图中所示H、I溶液的转化反应为氧化还原反应,E转化为H需加还原剂X,也是氧化还原反应,答案选B。
本题难度:一般
4、填空题 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: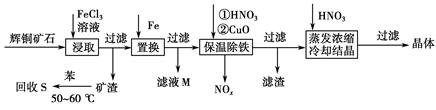
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
参考答案:(1)Cu2S+4Fe3+=2Cu2++4Fe2++S
(2)温度高苯容易挥发 温度低溶解速率小
(3)4NOx+(5-2x)O2+2H2O=4HNO3 b
(4)调节溶液的pH,使铁完全转化为Fe(OH)3沉淀 抑制Cu2+的水解(不带入其他杂质)
本题解析:(1)反应物为Cu2S和FeCl3,由流程信息可知产物有Cu2+、S,FeCl3作氧化剂,还原产物为Fe2+。Cu2S总化合价升高4,而Fe3+降低1,所以Cu2S前配1,Fe3+前配4。(2)从苯的物理性质和溶解速率着手分析。(3)NOx→HNO3,氮元素化合价由+2x→+5,化合价变化(5-2x),O2化合价降低4,守恒配平。滤液M是铁置换CuCl2中铜后的FeCl2溶液,氯化可生成循环使用的FeCl3溶液。(4)实验的目的是除铁,①加硝酸氧化Fe2+→Fe3+,②加CuO调节pH沉淀Fe3+。由于Cu2+能水解,蒸发Cu(NO3)2时需要加HNO3以抑制水解。
本题难度:困难
5、实验题 如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白: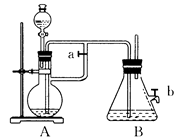
(1)B中盛有?溶液,A中应预先加入的药品是________,A中反应的离子方程式是:_________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程________。这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生反应的化学方程式为:____________________。现象?。
参考答案:(1)NaOH;铁屑;Fe+2H+=Fe2++H2↑?(2)打开
(3)关闭活塞a,让A中产生的氢气将A中FeSO4溶液压入B中发生反应:A中液面逐渐沿导管上升并进入B中,产生白色沉淀
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀逐渐变成灰绿色,最后变成红褐色。
本题解析:打开活塞a,先在烧瓶A中加入Fe粉,通过分液漏斗向烧瓶A中滴加无挥发性的稀硫酸,这时发生反应:Fe+2H+=Fe2++H2↑。产生的氢气把锥形瓶B中是NaOH溶液里的空气驱赶掉。是B中处于氢气的环境中。关闭活塞b。再关闭活塞a, 由于A中不断产生氢气,使得A中的压强越来越大。这时A中产生的氢气将A装置中的FeSO4溶液通过导气管压入B中,发生反应Fe2++2OH-=Fe(OH)2↓.由于整个装置都处于H2的还原性环境中,所以可以较长时间的观察的Fe(OH)2的白色沉淀。当实验完毕,打开b处活塞,空气进入到装置B中,此时B瓶中发生反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。会看到:白色沉淀逐渐变成灰绿色,最后变成红褐色;说明Fe(OH)2不稳定,容易被空气中的氧气氧化为红褐色的Fe(OH)3。2的实验室制法、及被空气中的氧气氧化过程的现象的观察的知识。
本题难度:一般