时间:2019-06-25 21:51:30
1、选择题 升高温度,下列数据不一定增大的是
A.弱电解质的电离常数
B.反应的活化分子百分数
C.化学平衡常数
D.化学反应速率
参考答案:C
本题解析:弱电解质的电离为吸热反应,故升高温度则弱电解质电离正向移动,故弱电解质电离常数增大,故A项错误;升高温度反应体系中各组分吸收能量分子本身能量增大,故反应活化分子数目增多,百分数增大,故B项错误;化学反应按能量变化可以分为吸热反应和放热反应,吸热反应升高温度平衡正向移动,故平衡常数增大,放热反应升高温度平衡逆行移动,故平衡常数减小,故C项不一定增大,C项正确;升高温度化学反应速率增大,故D项错误;本题选C。
考点:温度对化学反应影响。
本题难度:一般
2、选择题 以下电离方程式书写正确的是
A. H2S 2H++S2-
2H++S2-
B.CaCO3=Ca2++CO32-
C. NaHCO3 Na++HCO3-
Na++HCO3-
D.NaHS = Na++H++S2-
参考答案:B
本题解析:略
本题难度:一般
3、填空题 已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=?。
(2)HA的电离平衡常数K=?;
(3)升高温度时,K?(填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的?倍。
参考答案:(1)1.0×10-4 mol/L
(2)1×10-7
(3)增大 (4)106
本题解析:(1)HA电离出的c(H+)=0.1×0.1% mol/L=1×10-4 mol/L;
(2)电离平衡常数
K= =
=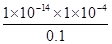 =1×10-7;
=1×10-7;
(3)因HA的电离是吸热过程,升高温度c(H+)、c(A-)均增大,则K增大;
(4)c(H+)HA=1×10-4 mol/L,c(H+)水=c(OH-)= =1×10-10 mol/L,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。
=1×10-10 mol/L,所以c(H+)HA∶c(H+)水=(1×10-4)∶(1×10-10)=106。
本题难度:一般
4、选择题 室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的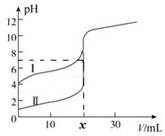
A.I曲线表示的是滴定盐酸的曲线
B.x=20
C.滴定过程中c(NH4+)/c(NH3·H2O)的值逐渐减小
D.当I曲线和II曲线pH均为7时,一溶液中的c(Cl-)等于另一溶液中的c(CH3COO-)
参考答案:C
本题解析:A、由图可知II曲线表示的是滴定盐酸的曲线,错误;B、用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,pH=7时,消耗氨水的体积不是20ml,错误;C、滴定过程中,c(NH4+)逐渐增多,c(NH3·H2O)的值逐渐减小,故c(NH4+)/c(NH3·H2O)的值逐渐减小,正确;D、当I曲线和II曲线pH均为7时,一溶液中的c(Cl-)小于另一溶液中的c(CH3COO-),错误;故本题选择C。
考点:滴定曲线的判断
本题难度:一般
5、选择题 下列各选项中所述的两个量,前者一定大于后者的是
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数
B.pH=1的CH3COOH溶液和盐酸的物质的量浓度
C.pH=12的氨水和NaOH溶液的导电能力
D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积
参考答案:B
本题解析:A错,虽两者溶质的物质的量相等,但对于弱电解质醋酸来说,越稀越易电离,电离程度越大,即,1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数前者一定小于后者;B正确;C错,电解质溶液的导电性强弱与溶液中自由移动的离子浓度有关,浓度越大,溶液的导电性越强;D错,pH相同的等体积的盐酸和醋酸溶液,醋酸的物质的量更多,与足量锌粒反应产生的气体体积更多;
本题难度:一般