时间:2019-06-25 21:46:59
1、填空题 铁及铁的化合物在生产、生活中有着重要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(SO4)(3-n)/2]m,现污水处理工艺中利用PFS在水体中形成絮状物,以吸附金属离子。与PFS中铁元素价态相同的铁的离子的电子排布式为____________。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用作显影剂,该化合物中存在的化学键类型有___________。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
CN-中碳原子的杂化轨道类型是_________,写出一种与CN-互为等电子体的离子的化学式________。
(3)三氯化铁在常温下为固体,熔点304℃,沸点316℃,在300℃以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为___________晶体。
(4)普鲁士蓝可用作染料,它的结构如图所示。普鲁士蓝中,n(K+):n(Fe3+):n(Fe2+):n(CN-)=_____。 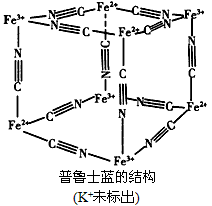
参考答案:(1)1s22s22p63s23p63d5或[Ar]3d5
(2)ABD;sp;C22-
(3)分子
(4)1:1:1:6
本题解析:
本题难度:一般
2、填空题 钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴的配位化合物[Co(NH3)xCly]Clz(相对分子质 量为250.5)的组成,进行如下实验:
①称取样品0.5010g,加入过量的NaOH溶液,煮沸蒸出所有的氨气,测得氨气的体积为224.0mL(已折换 为标准状况下)。
②另称取该物质样品0.2505g,溶于水,以0.1000mol/L AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:[Co(NH3)xCly]Clz+zAgNO3=[Co(NH3)xCly](NO3)z+zAgCl↓ 通过计算求:
(1)该钴化合物的化学式。
(2) [Co(NH3)xCly]Clz中Co元素的化合价为__________,Co的配位数为___________。
参考答案:(1)[Co(NH3)5Cl]Cl2
(2)+3;6
本题解析:
本题难度:一般
3、选择题 已知信息:[Cu(NH3)4]SO4的电离方程式:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。具有6个配体的Co3+的配合物CoClm·nNH3,若1mol此配合物与足量的AgNO3溶液反应只生成1molAgCl沉淀,则m、n 的值分别是
[? ]
A.m=1、n=5
B.m=3、n=4
C.m=5、n=1
D.m=3、n=3
参考答案:B
本题解析:
本题难度:一般
4、选择题 关于配合物[Zn(NH3)4]Cl2的说法正确的是?
[? ]
A.配位数为6?
B.配体为NH3和Cl-?
C.[Zn(NH3)4]2+为内界?
D.Zn2+和NH3以离子键结合
参考答案:C
本题解析:
本题难度:一般
5、填空题 有两种配合物A和B,它们的组成为Co:21.95%,Cl:39.64%,N:26.08%, H:6.38%,O:5.95%,并根据下面的实验结果确定它们的配离子、中心离子和配位数。
(1)A和B的水溶液都呈微酸性,加入强碱并加热至沸腾时,有氨气放出,同时析出CO2O3沉淀。
(2)向A和B的溶液中加入硝酸银溶液时都生成AgCl沉淀。
(3)过滤除去两种溶液中的沉淀后,再加硝酸银均无变化,但加热至沸腾时,在B的溶液中又有AgCl沉淀生成,其质量是原来析出沉淀质量的一半。
________________________________
参考答案:A:[Co(NH3)5(H2O)]Cl3 配离子:[Co(NH3)5(H2O)]3+ 配位数:6 中心离子:Co3+
B:[Co(NH3)5Cl]Cl2 H2O 配离子:[Co(NH3)5Cl]2+ 配位数:6 中心离子:Co2+
H2O 配离子:[Co(NH3)5Cl]2+ 配位数:6 中心离子:Co2+
本题解析:
本题难度:一般