时间:2019-06-25 21:43:34
1、选择题 下列图示与对应的叙述相符的是(? )。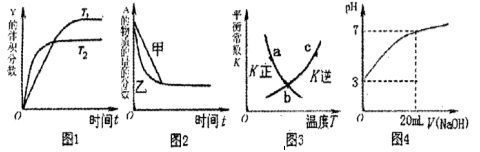
A.图1表示可逆反应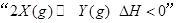 温度
温度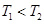 的情形
的情形
B.图2表示压强对可逆反应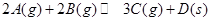 的影响,乙的压强比甲的压强大
的影响,乙的压强比甲的压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
2、计算题 反应 发生在2L的密闭容器中,5 min内NH3的质量增加了1.7 g 求
发生在2L的密闭容器中,5 min内NH3的质量增加了1.7 g 求
 。
。
3、选择题 如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是(? ) 
A.反应达平衡时,正反应速率和逆反应速率相等
B.同一种反应物在平衡态I和平衡态II时浓度不相等
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
4、填空题 钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)-Q
NaCl(l)+K(g)-Q
各物质的沸点与压强的关系如下表。
| 压强/kPa | 13.33 | 53.32 | 101.3 |
| K的沸点/℃ | 590 | 710 | 770 |
| Na的沸点/℃ | 700 | 830 | 890 |
| KCl的沸点/℃ | ? | ? | 1 437 |
| NaCl的沸点/℃ | ? | ? | 1 465 |
5、填空题 (11分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下: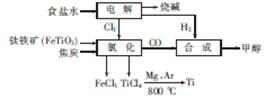
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密?闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是?
CH3O(H(g)。若在恒容密?闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是?
?(填字母)。
a.容器内压强保持不变? b.容器内气体密度保持不变
c.c(CO)=c(CH3OH)? d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式:?。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是?。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为?。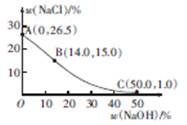
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛?g(精确到0.1,下同),甲醇厂CO的转化率为?。