时间:2019-06-25 21:26:00
1、选择题 在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中正确的是( )
H++Cl-+HClO。下列说法中正确的是( )
A.光照一段时间后,c(HClO)减小
B.加入碳酸钙粉末后,溶液的pH增大,可以提高HClO浓度
C.加入少量水,由水电离的c(H+)减小
D.加入少量NaOH固体, 增大
增大
参考答案:B
本题解析:A选项,光照HClO分解使平衡右移,HClO均减小;B选项,碳酸钙消耗H+,正确;C选项,加入少量水使HCl、HClO浓度减小,水的电离程度增大,错误;D选项,NaOH与H+反应,上述比值减小
本题难度:一般
2、选择题 在一真空密闭容器中,充入10 mol N2和30 mol H2,发生N2+3H2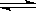 2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
A.15 mol、25%
B.20 mol、50%
C.20 mol、75%
D.40 mol、80%
参考答案:C
本题解析:根据第一次反应的氢气转化率计算,最后平衡时氮气为7,5mol,氢气为22.5mol,氨气为5mol,只有C选项反应后氨气剩余5mol符合。
点评:本题的计算方法不难,需掌握清楚各物质的起始量,变化量和最终量,难度不大。
本题难度:简单
3、计算题 丙酮(CH3COCH3)和碘在酸性溶液中发生下列反应:CH3COCH3+I2→CH3COCH2I+H++I-。 25℃时,该反应的速率由下列经验式决定:v=2.73×10-5c(CH3COCH3)·c(H+)mol/(L·s),25 ℃时,如果c(I2)、c(CH3COCH3)、c(H+)的起始浓度依次是0.01 mol/L、0.1 mol/L、0.01 mol/L。求:
(1)反应开始时的速率;
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
参考答案:(1)2.73×10-8 mol/(L·s)
(2)3.89×10-8mol/(L·s)>2.73×10-8mol/(L·s),反应速率比开始时快。
本题解析:
本题难度:一般
4、简答题 (14分)I.已知:C(s)+H2O(g) CO(g)+H2(g)?ΔH
CO(g)+H2(g)?ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |

参考答案:(14分,每空2分))
I.(1)AD?(2)P/P0? 79.82%(或0.80)
II.(1)xCOS(g) =" xCO(g)+" Sx(s)?ΔH=0.5(bx-ax)kJ/mol
(2)①HS- ?c(Na+)=3[c(H2S)+c(HS-)+c(S2-)](由物料守恒得出)
或c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+)(由电荷守恒得出)
②M:2S2-+3H+=HS-+H2S
本题解析:I.(1)因为该反应中有固体参与,所以气体的质量一直变化,而容器的体积不变,所以当混合气体的密度不再发生改变时,证明已达平衡状态,正确;B、消耗1 mol H2O(g)的同时生成1 mol H2
都是正反应方向,不能证明反应达平衡状态,错误;C、反应方程式固定,则反应的ΔH固定,所以不能判断化学平衡状态是否到达,错误;D、CO和H2的物质的量之比是1:1,所以v正(CO) = v逆(H2)时符合正逆反应速率相等,说明反应达平衡状态,正确,答案选AD;
(2)开始时气体的物质的量为1mol,根据恒温恒容条件下,气体的物质的量之比等于气体的压强之比得n总=P/P0mol,由表中数据可知平衡时的压强为8.20(100Kpa),开始的压强为4.56(100Kpa),设消耗水蒸气的物质的量为xmol,则平衡时H2O(g)、CO(g)、H2(g)的物质的量(mol)分别为1-x、x、x,根据n总=P/P0mol,得1-x+x+x=8.20/4.56,解得x=0.7982,所以反应物H2O(g)的转化率α =79.82%;
II.(1)根据盖斯定律得目标方程式=(②-①)/2,所以所求热化学方程式为xCOS(g) =" xCO(g)+" Sx(s)?ΔH=0.5(bx-ax)kJ/mol;
(2)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,盐酸先与氢氧化钠反应生成氯化钠和水,再与硫化钠反应生成硫氢化钠,此时溶液中S2?的含量逐渐减小,HS?的含量逐渐增大,继续滴加盐酸,则HS?与氢离子结合生成硫化氢,则溶液中H2S的含量逐渐增大,HS?的含量逐渐减小,所以A、B、C分别代表S2? 、HS?、H2S的分数变化。B曲线代表、HS?的分数变化;根据物料守恒,Na元素的浓度是S元素浓度的3倍,可得滴加过程中,溶液中一定成立的是c(Na+)=3[c(H2S)+c(HS-)+c(S2-)];滴加的过程中溶液中始终存在Na+、Cl-、HS-、S2-、OH-、H+,根据电荷守恒可得c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
②M点表示HS-与S2-分数相等,所以溶液中发生的总的离子方程式为2S2-+3H+=HS-+H2S
本题难度:一般
5、选择题 下列说法错误的是( )
A.任何化学反应都有一定的限度,只是不同反应的限度不同罢了
B.化学反应的限度可以通过改变条件而改变,如浓度、温度和压强
C.可逆反应既可以向正反应方向进行,同时又可向逆反应方向进行的反应
D.当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应就停止了
参考答案:D
本题解析:当一个可逆反应进行到正向反应速率与逆向反应速率相等时,即化学平衡状态。
本题难度:一般