时间:2019-06-25 21:02:45
1、选择题 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是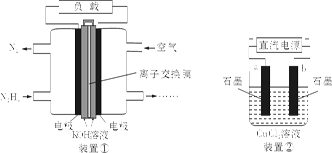
A.该燃料电池负极发生的电极反应为:N2H4+4OH-?4e-==N2↑+4H2O
B.用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4
C.该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧
D.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
参考答案:B
本题解析:A.原电池中负极失去电子,发生氧化反应,则该燃料电池负极通入的是燃料肼。由于电解质是氢氧化钾,所以发生的电极反应为:N2H4+4OH-?4e-==N2↑+4H2O,A正确;B.用该燃料电池作为装置②的直流电源,产生7.1g Cl2即0.1mol氯气时转移0.2mol电子,则根据电子得失守恒可知至少需加入0.2mol÷4=0.05 mol N2H4,B错误;C.原电池中负极失去电子,则电子从负极通过外电路流向正极,即该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液中阴离子OH-向负极移动,即迁移到左侧,C正确;D.该燃料电池的电极材料应采用多孔导电材料,增大接触面积以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,D正确,答案选B。
考点:考查电化学原理的应用
本题难度:一般
2、填空题 (1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是 。?
A.C(s)+H2O(g) CO(g)+H2(g) ΔH>0
CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH<0
NaCl(aq)+H2O(l) ΔH<0
C.2H2(g) +O2(g) 2H2O(l) ΔH<0
2H2O(l) ΔH<0
D.CaCO3(s)+2HCl(aq) CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
E.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH<0
CO2(g)+2H2O(l) ΔH<0
(2)有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断A、B、C、D的活动性由强到弱的顺序是 。?
参考答案:(1)CE (2)D>A>B>C
本题解析:(1)原电池是自发进行的氧化还原反应,由条件知反应通常是放热反应,A为吸热反应,B、D不是氧化还原反应,选C、E。(2)本题考查原电池原理的应用。根据原电池原理:活动性不同的金属组成原电池时,活泼金属作负极,失电子,发生氧化反应,较不活泼的金属作正极,据此可以判断金属活动性的强弱。活泼金属作负极,被腐蚀,所以活动性A>B;A、D与等浓度盐酸反应时D比A反应剧烈,说明活动性D>A;铜与B的盐溶液不反应,但铜可置换出C,说明活动性B>C。即活动性由强到弱的顺序为D>A>B>C。
本题难度:一般
3、选择题 下列关于原电池的叙述中,错误的是
A.用导线连接的两种不同金属同时插入液体中,就能形成原电池
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.在原电池中,电子流入的一极是正极,发生还原反应
参考答案:A
本题解析:A:活性不同的两金属或非金属、电解质溶液通过形成闭合回路,才能形成原电池,但前提是必须有自发进行的氧化还原反应,不正确
B:正确
C:负极失电子,流出电子,发生氧化反应,正确
D:经导线电子流入正极,物质在正极得电子,发生还原反应,正确
本题难度:一般
4、选择题 如图装置所示,铜片上发生的反应为
A.Zn2++ 2e一 =Zn
B.2H++2e一= H2 ↑
C.Zn一2e一=Zn2+
D.Cu2++2e一= Cu
参考答案:B
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子,所以答案选B.
本题难度:一般
5、选择题 X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡,W、Y相连时,W极发生氧化反应。据此判断四种金属的活动顺序是( )
A.X>Z>W>Y
B.Z>X>Y>W
C.X>Y>Z>W
D.Y>W>Z>X
参考答案:A
本题解析:在原电池中,活泼金属作为电池的负极,失去电子发生氧化反应;不活泼的金属作为电池的正极,得到电子发生还原反应。电子由负极经导线流向正极,与电流的方向相反(物理学中规定正电荷移动的方向为电流的方向)。因此,X、Y相连时,X为负极,则活泼性X>Y;Z、W相连时,电流方向是W→Z,则活泼性Z>W;X、Z相连时,Z极上产生大量气泡,则活泼性X>Z,W、Y相连时,W极发生氧化反应,则W>Y。综上,可以得出金属的活泼性顺序是X>Z>W>Y。
本题难度:一般