时间:2019-06-25 20:59:58
1、选择题 右图表示在密闭容器中C(s)+H2O(g)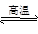 CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是(? )
CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是(? )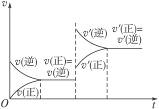
A.增加CO浓度
B.升高温度
C.增大压强
D.增加水蒸气
参考答案:C
本题解析:正、逆反应速率突然增大,只能从B、C中选,由于升温向正反应方向移动,v′(正)>v(逆)与图不符,只能是增大压强引起。
本题难度:简单
2、选择题 2012年是勒夏特列诞生192周年,下列叙述中,不用平衡移动原理解释的是 (? )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
参考答案:C
本题解析:A、存在平衡2NO2(g) N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,所以可以用平衡移动原理解释;B、存在平衡2SO2+O2(g)
N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,所以可以用平衡移动原理解释;B、存在平衡2SO2+O2(g) 2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释;C.存在平衡H2+I2(g)
2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释;C.存在平衡H2+I2(g) 2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释;D、黄绿色的氯水存在平衡:Cl2+H2O
2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释;D、黄绿色的氯水存在平衡:Cl2+H2O HCl+HClO,光照HClO分解浓度降低,平衡向正向移动,颜色变浅,可用平衡移动原理解释
HCl+HClO,光照HClO分解浓度降低,平衡向正向移动,颜色变浅,可用平衡移动原理解释
本题难度:一般
3、选择题 在某恒定温度下,向容积为1 L的容器中投入1 mol CO和2 mol H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时生成CO2 2/3 mol。若保持温度和容积不变,向其中增加2 mol H2O(g),使反应到达新的平衡,下列说法不正确的是(?)
A.新、旧平衡时容器内气体的压强之比是5:3
B.新平衡时H2O的转化率为20%
C.新平衡时CO的浓度是0.2 mol ·L-1
D.新、旧平衡时容器内气体密度之比为5:3
参考答案:D
本题解析:略
本题难度:一般
4、选择题 25℃时,有关弱酸的电离平衡常数如下,则下列有关说法不正确的是(? )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7? K2=5.6×10-11 |
参考答案:C
本题解析:根据25℃时,若同浓度的醋酸和氢氧化钠等体积混合后生成醋酸钠,强碱弱酸盐显碱性。若溶液pH=8,则由c(OH-)×c(H+)="Kw" 和 PH=—lgC(H+)得
c(OH-)-c(H+)=9.9×10-7mol/L?由电荷守恒得c(Na+) + c(H+)? =c(OH_)+c(CH3COO-)
c(Na+)-c(CH3COO-)=9.9×10-7mol/L ,所以A正确;25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等,正确,因为 PH=—lgC(H+) ;NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)这是电荷守恒,所以D正确;
弱酸的电离平衡常数可以看到:醋酸最强,碳酸次之,接下来是氢氰酸,碳酸氢根最弱,所以他们对应的钠盐,PH 的大小关系是pH(Na2CO3)>(NaCN)>pH(CH3COONa),所以C错误。故选C。
点评:这是教学的重难点,也是考试的重点。弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量为幂的乘积的比值,即溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数。这个常数叫电离平衡常数,简称电离常数。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:简单
5、选择题 一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳。对此反应,下列叙述中正确的是( )
A?使用催化剂能改变平衡常数? B?使用催化剂能改变反应速率
C?改变压强对反应速率没有影响? D?降低压强能加大反应速率
参考答案:B
本题解析:平衡常数只与温度有关系,A不正确。有气体参加的反应,改变压强可以改变反应速率,C不正确。降低压强,反应速率降低,D不正确,所以正确的答案是B。
本题难度:一般