时间:2019-06-25 20:59:58
1、选择题 下列叙述表示可逆反应N2 + 3H2 2NH3一定处于平衡状态的是………?(?)
2NH3一定处于平衡状态的是………?(?)
A.N2、H2、NH3的百分含量相等
B.3v(N2)正= v(H2)逆
C.定容容器中,气体的密度不变
D.N2、H2、NH3的浓度之比为1:3:2
参考答案:B
本题解析:A.当反应达到平衡状态时反应混合物中任何组分的物质的量、物质的量浓度不变。但是N2、H2、NH3的百分含量可能相等也可能不等。错误。B.在任何时刻v(N2)正= 3v(H2)正,而3v(N2)正= v(H2)逆;则v(H2)正= v(H2)逆反应达到平衡。正确。C.因为反应是在定容容器中进行,反应前后 的质量不变,所以无论反应是否达到平衡,气体的密度都不变。因此不能作为判断平衡的标志。错误。D.当反应达到平衡时,N2、H2、NH3的浓度之比可能为1:3:2,也可能不是。因此不能作为判断反应是否达到平衡的标志。错误。
本题难度:一般
2、选择题 可逆反应X+Y Z达到平衡时,下列各种说法错误的是( )
Z达到平衡时,下列各种说法错误的是( )
A.升高温度,的比值减小,表明正反应是吸热反应
B.增大压强,平衡不移动,说明Y,Z都是气体
C.若Y是气体,增大X的浓度,可使Y的转化率升高
D.若增大压强,混合气体的平均分子质量一定增加
参考答案:BD
本题解析:A选项中,升高温度,的比值减小,说明平衡向正反应方向移动,升高温度向吸热方向移动,说明正反应是吸热反应,故A选项正确。B选项中,增大压强平衡不移动,说明反应前后气体的计量数相等,或都不是气体。C选项中,增大一种反应物的浓度能提高另一种反应物的转化率,正确。D选项中,增大压强有可能平衡不移动。
本题难度:一般
3、选择题 在容积为VL密闭容器中,放入2L A(g)和1L B(g),发生:3A(g)+B(g)  ?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小
?aC(g)+2D(g)。达到平衡后,A物质的量浓度减小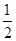 ,混合气体的平均摩尔质量增大
,混合气体的平均摩尔质量增大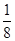 ,则方程式中a值是
,则方程式中a值是
A.1
B.2
C.3
D.4
参考答案:A
本题解析:平衡时,混合气体的平均摩尔质量增大,这说明正反应是体积减小的可逆反应,所以3+1>a+2,所以a<2,所以a=1,答案选A。
本题难度:简单
4、选择题 一定条件下,在2SO2+O2  2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 : 0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是?(?)
2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 : 0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是?(?)
A.0.8—2mol/L
B.0—2mol/L
C.0—0.8mol/L
D.无法确定
参考答案:B
本题解析:根据可逆反应的最大特点是不完全进行,所以最低不能为0 mol/L,2.4mol/L SO3最多可生成1.2mol/L,但是不能生成1.2mol/L,所以最大值是2mol/L。
本题难度:简单
5、选择题 将2?molX和2molY充入2L密闭容器中发生如下反应: X(气)+3Y(气) ?2Z(气)+aQ(气) 2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是?
?2Z(气)+aQ(气) 2min达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是?
[? ]
A.a的值为2
B.平衡时X的浓度为0.2mol/L
C.Y的转化率为60%
D.反应速率v(Y)=0.3mol/(L?min)
参考答案:B
本题解析:
本题难度:一般