时间:2019-05-30 05:58:28
1、推断题 已知A、B、E是常见的非金属单质,C是导致酸雨的主要成分之一,Y是生活中常见的金属单质。D、K是重要的无机化工产品。X含有两种元素,具有摇篮式的分子结构,其球棍模型如图所示。H为白色沉淀。下列转化关系中部分反应条件和产物略去。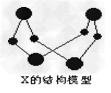
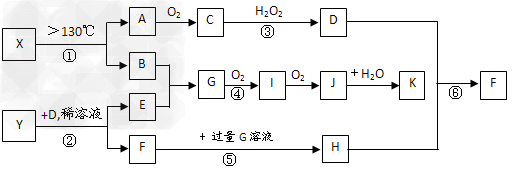
试回答下列问题
(1)X的化学式为______________;G的电子式______________;
(2)反应④的化学方程式_______________________;反应③的离子方程式____________________________;?
(3)用水稀释0.1?mol/LG溶液时,溶液中随着水量的增加而减小的是_______(填写序号)? ①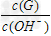 ?②
?②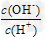 ?③?c(H+)和c(OH-)的乘积?④?OH-的物质的量
?③?c(H+)和c(OH-)的乘积?④?OH-的物质的量
(4)室温下,向0.01mol/L?G溶液中滴加0.01mol/L?D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
(5)①~⑥反应中属于氧化还原反应的是(填编号)___________;
(6)依据实验中的特征实验现象,可确定Y是何种金属,该实验现象为____________。
2、填空题 (7分)有A、B、C、D四种单质。在一定条件下,B可以和A、C、D化合生成化合物甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙每个分子中都含有10个电子,并且甲、乙、丙、丁有如下关系:
回答:
(1)单质B的化学式。
(2)单质A与化合物乙反应的化学方程式。
(3)根据化合物丙、丁中D 元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由。
元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由。
3、简答题 以下为中学常见物质,转化关系如下.C与B溶液反应产生气体F,D可在F中燃烧,图中部分产物略去.
(1)写出固体C化学式______.
(2)实验室用①制取D、B溶液应为______溶液(“浓”或“稀”);若用②制取F,B溶液应为______溶液(“浓”或“稀”).写出②反应方程式______.
(3)如何检验E中的阳离子______.
(4)实验室配制G溶液,操作为______.
(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式______.
(6)4gD在空气中完全燃烧生成液体物质时,放出热量为QkJ,写出该反应的热化学方程式______.
4、填空题 a、b、c、d、e、f、g为七种由1~18号元素构成的微粒,它们都有10个电子,其结构特点如下表:
| 微粒代码 | a | b | c | d | e | f | g 原子核数 单核 单核 多核 单核 双核 多核 多核 所带单位电荷 1+ 2- 0 3+ 1- 0 1+ |
5、填空题 (14分)A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物。单质X、Y是生活中常见的金属,相关物质间的转化 关系如下图所示(部分反应物与产物已略去):
关系如下图所示(部分反应物与产物已略去):
(1)若试剂l与试剂2不属于同类物质,则X与试剂l反应的离子方程式是? ?。
?。
(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是?。
①检验物质D的溶液中金属离 子的实验操作是?。
子的实验操作是?。
②将物质C溶于水,其溶液呈?(填“酸性”、“中性”或“碱性”),原因用离子方程式可表示为?。
(3)若E溶液隔绝空气加热蒸干后可得到该溶液的溶质,工业上以E、稀硫酸和NaNO2为原料来制备高效净水剂Y(OH)SO4,反应中有N0生成,该反应的化学方程式是?。