时间:2019-05-30 05:50:27
1、填空题 (12分) 电化学原理在化学工业中有广泛应用。请根据下图回答有关问题
(1)装置I中能量的转化形式是?。导线上电子定向移动方向从?极到?极。其电极反应式?。
(2)装置II中若X、Y都是惰性电极,a是CuCl2溶液。则发生氧化反应的电极是?和?。检验X电极反应产物的方法是?。
若a是饱和NaCl溶液(氯碱工业生产原理),电极材料是石墨电极和铁电极。实验开始时,同时在两极各滴入几滴酚酞试液,则?(填“石墨或铁”)附近溶液先变红,其电极反应式?。
(3)当装置I和装置II的电路中均转移0.2mol电子时,则装置I中铁电极质量的变化
?g(填写“增加”或“减少”及具体质量),装置II中收集到的气体共有?L(标准状况下)(以装置II中X、Y是惰性电极,a是CuCl2溶液计算)。
参考答案:(12分) (1)化学能转化为电能?。从负(Al)极到正(Fe)极。
负极:2Al-6e-=2Al3+?正极:3Cu2++6e-=3Cu
或负极: Al-3e-=Al3+?正极: Cu2++2e-=Cu
(2)Zn和X。用湿润的KI-淀粉试纸,使之变蓝色证明有Cl2。
Fe,阴极:2H2O +2e-=2OHˉ+H2
(3)增加6.4g,? 4.48?L(标准状况下)
本题解析:略
本题难度:一般
2、选择题 下列装置或操作能达到实验目的是( )
A.
构成铜锌原电池
B.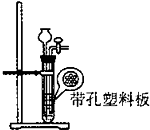
二氧化碳制取装置
C.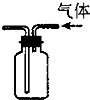
利用排空气法收集H2
D.
实验室制取并收集氨气
参考答案:C
本题解析:
本题难度:简单
3、填空题 (10分) I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是?腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:?
II.①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在答题卡上画出能够实验这一反应的装置图,并在图中进行必要的标注。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:?
参考答案:I.(1)吸氧(1分)?(2)O2+4e-+2H2O=4OH-?(2分)
II.①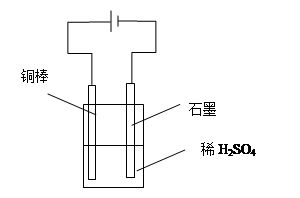
 (5分,图2分,标注3分)
(5分,图2分,标注3分)
②该同学将铜棒连接在电源负极上,反应实质为电解水。(2分)
本题解析:(1)钢铁腐蚀主要是电化学腐蚀,其中又以吸氧腐蚀为主。
(2)原电池中正极得到电子,因此正极是氧气得到电子,电极反应式为O2+4e-+2H2O=4OH-。
(3)①铜在金属活动顺序表中排在H的后面,不能置换出酸中的H,因此要使反应发生,则应该通过电解实现。其中铜失去电子,所以铜和电源的正极相连,作阳极。电解质溶液是硫酸,如图所示(见答案)。
②碳棒上有气泡产生,但铜棒却没有被腐蚀,这说明碳棒是阳极,铜是阴极,即该同学将铜棒连接在电源负极上,反应实质为电解水。
本题难度:一般
4、选择题 用惰性电极分别电解下列物质的水溶液一段时间后,溶液的pH会升高的是
A.Ba(NO3)2
B.CuSO4
C.HNO3
D.NaOH
参考答案:D
本题解析:考查电极产物的判断。惰性电极电解硝酸钡、氢氧化钠和硝酸得失相当于电解水,所以选项A中pH不变;选项C中pH降低;选项D中pH增大;而电解硫酸铜,生成物是铜、氧气和硫酸,所以pH降低,答案选D。
本题难度:简单
5、选择题 铁棒和石墨棒用导线连接后,浸入0. 01mol/L 的氯化钠溶液中,下列说法正确的是
A.铁棒附近产生OH—
B.铁棒质量减少
C.石墨棒上放出氢气
D.石墨棒上放出氧气
参考答案:B
本题解析:属于原电池,先判断电极材料不能与电解质溶液反应,可知为吸氧腐蚀,A.OH—在石墨附近产生,错误;B.铁棒受腐蚀而质量减少,正确;C.石墨棒上没有氢气析出,错误;D.吸收氧气而不是放出,错误。
本题难度:一般