时间:2019-05-30 05:48:04
1、选择题 向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是
A.[Co(NH3)4Cl2]Cl
B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3
D.[Co(NH3)5Cl]Cl2
参考答案:B
本题解析:选项B中的氯原子和铜离子形成配位键,不能电离出氯离子,所以不能生成氯化银沉淀。其余都能电离出氯离子,所以正确的答案选B。
本题难度:一般
2、实验题 (14分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
参考答案:(1)环形玻璃搅拌棒
(2)减少实验过程中的热量损失
(3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量,与酸碱的用量无关
(5)偏小
本题解析: (1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)盐酸和氢氧化钠中和热的热化学方程式为:HCl(aq)+NaOH(aq)=H2O(l)△H="-57.3" kJ?mol-1,故答案为:HCl(aq)+NaOH(aq)=H2O(l)△H="-57.3" kJ?mol-1;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小.
考点:中和热的测定。
本题难度:一般
3、选择题 已知在101kPa,25℃条件下,1mol氢气燃烧生成水蒸气放出242kJ热量,下列热化学方程式正确的是
A.H2(g)+ 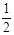 O2(g)=H2O(g) ΔH=+242kJ?mol-1
O2(g)=H2O(g) ΔH=+242kJ?mol-1
B.2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ?mol-1
C.H2(g)+ 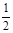 O2(g)=H2O(l)ΔH=-242kJ?mol-1
O2(g)=H2O(l)ΔH=-242kJ?mol-1
D.2H2(g)+O2(g)=2H2O(g)ΔH=-242kJ?mol-1
参考答案:B
本题解析:A.放出热量用负值,错误;B.正确;C.应生成水蒸气,错误;D. 1mol氢气燃烧生成水蒸气放出242kJ热量,错误;选B。
考点:考查热化学方程式的书写。
本题难度:一般
4、选择题 下列反应的离子方程式正确的是
A.铁片插入氯化铁溶液中:Fe3++Fe=2Fe2+
B.少量金属钠放到硫酸铜溶液中:Cu2++2Na=Cu+2Na+
C.少量金属钠放到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
参考答案:D
本题解析:分析:A.电子、电荷不守恒;
B.反应生成氢氧化铜、氢气、硫酸钠;
C.没有配平;
D.反应生成氯化铜和水,氢氧化铜、水在离子反应中保留化学式.
解答:A.铁片插入氯化铁溶液中的离子反应为2Fe3++Fe=3Fe2+,故A错误;
B.少量金属钠放到硫酸铜溶液中的离子反应为2H2O+Cu2++2Na=Cu(OH)2↓+H2↑+2Na+,故B错误;
C.少量金属钠放到冷水中的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.氢氧化铜加到盐酸中的离子反应为Cu(OH)2+2H+=Cu2++2H2O,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意选项B为解答的难点和易错点,题目难度中等.
本题难度:一般
5、填空题 (12分)N2(g)+3H2(g) 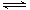 2NH3(g)反应过程的能量变化如下图所示。
2NH3(g)反应过程的能量变化如下图所示。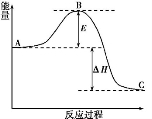
已知生成1 mol NH3(g)的ΔH=-46 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示 、 ;若该反应使用催化剂,会使图中B点升高还是降低? 。
(2)图中ΔH= kJ·mol-1。
(3)已知恒容时,该体系中各物质浓度随时间变化的曲线如图所示。
①在0.5 L容器中发生反应,前20 min内,v(NH3)=________,放出的热量为________。
②45 min时采取的措施是_______________________。
③比较I、II、III时段的化学平衡常数(分别用K1、K2、K3表示)大小________。
参考答案:21.(1)反应物总能量; 生成物总能量; 降低;(每空各1分) (2)-92
(3)①0.050 mol/(L·min) (1分); 23.6 Kj ②降低体系温度 ③K3>K1=K2
本题解析:(1)由图可知,图中A、B分别表示反应物总能量;生成物总能量,催化剂降低反应的活化能,所以若该反应使用催化剂,会使图中B点降低;(2)因为生成1 mol NH3(g)的ΔH=-46 kJ·mol-1,则N2(g)+3H2(g) 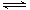 2NH3(g),ΔH=-92 kJ·mol-1,所以反应过程的能量变化ΔH=-92kJ·mol-1;
2NH3(g),ΔH=-92 kJ·mol-1,所以反应过程的能量变化ΔH=-92kJ·mol-1;
(3)①读图可知,前20min内氨气的浓度由0逐渐增大到1.0mol/L,根据定义式可得,v(NH3)=1.0mol/L÷20min=0.050mol/(L?min);氮气由1.0mol/L逐渐减小到0.50mol/L,根据c?V=n可求参加反应的氮气的物质的量,即(1.0—0.50)mol/L?0.5L=0.25mol,由于N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,放出的热量为94.4x0.25=23.6kJ热量;②读图可知,45min时氨气的浓度平缓上升,氮气和氢气的浓度则平缓下降,采取的措施是降低体系温度,平衡向正反应方向移动,则氮气、氢气的浓度均减小,氨气的浓度逐渐增大;③时段I和时段II温度不变,K1=K2,时段III降低温度,K值增大,所以K3>K1=K2。
2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,放出的热量为94.4x0.25=23.6kJ热量;②读图可知,45min时氨气的浓度平缓上升,氮气和氢气的浓度则平缓下降,采取的措施是降低体系温度,平衡向正反应方向移动,则氮气、氢气的浓度均减小,氨气的浓度逐渐增大;③时段I和时段II温度不变,K1=K2,时段III降低温度,K值增大,所以K3>K1=K2。
考点:考查反应热,化学反应原理。
本题难度:一般