时间:2019-05-30 05:47:23
1、选择题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①_________②___________ ③__________。
(2)溶液中共有________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol/L的是_________,浓度为0.002mol/L的是_________。
(4)__________和___________两种粒子物质的量之和等于0.01mol。
参考答案:(1)CH3COO-+H2O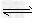 CH3COOH+OH-;CH3COOH
CH3COOH+OH-;CH3COOH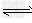 CH3COO-+H+;?H2O
CH3COO-+H+;?H2O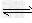 OH-+H+;
OH-+H+;
(2)7;
(3)Na+;Cl-;
(4)CH3COOH;CH3COO-
本题解析:
本题难度:一般
2、选择题 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合后,溶液pH >7,则以下关系式错误的是
A. c(A-)>c(HA)
B. c(HA) +c(A-) =0.1 mol/L
C. c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-)
D. c(Na+)=c(A-)+c(HA)
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.等体积等物质的量浓度的Na2CO3和Na2SO4溶液,Na2SO4溶液中的离子总数多于Na2CO3溶液
B.相同温度下,pH相等的NaHCO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液:c(C6H5ONa)>c(NaHCO3)>c(NaOH)
C.常温下,将CH3COONa溶液、HCl溶液混合所得中性溶液:c(Na+)=c(Cl-)>c(H+)=c(OH一)
D.0.1?mol?L-1Na2CO3溶液与0.1mol?L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+)
参考答案:A、等体积等物质的量浓度的Na2CO3和Na2SO4溶液中,碳酸钠水解,CO32-+H2O?HCO3-+OH-;HCOO3-+H2O?H2CO3+OH-;阴离子数增多,Na2SO4溶液中的离子总数小于Na2CO3溶液,故A错误;
B、相同温度下,pH相等的NaHCO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液,提供相同浓度的氢氧根离子,碱性越强的溶液,溶质浓度越小,C6H5ONa(苯酚钠)溶液碱性强于NaHCO3溶液,所以浓度大小为c(NaHCO3)>c(C6H5ONa)>c(NaOH),故B错误;
C、将CH3COONa溶液、HCl溶液混合所得中性溶液中存在电荷守恒,:c(Na+)+c(H+)=c(Cl-)+C(CH3COO-)+C(OH-),中性溶液c(H+)=C(OH-),所以得到c(Na+)=c(Cl-)+C(CH3COO-);故C错误;
D、根据电荷守恒①[Na+]+[H+]=2[CO32-]+[HCO3-]+[OH-];根据物料守恒:碳酸钠中②[Na+]=2[CO32-]+2[HCO3-]+2[H2CO3]:碳酸氢钠中③[Na+]=[CO32-]+[HCO3-]+[H2CO3]:0.1?mol?L-1Na2CO3溶液与0.1mol?L-1NaHCO3溶液等体积混合所得溶液中钠离子浓度②+③得到④2[Na+]=3[CO32-]+3[HCO3-]+3[H2CO3];①×2-④得到c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+);故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 关于盐类水解反应的说法正确的是
[? ]
A.溶液呈中性的盐一定是强酸强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱性的相对强弱
D.同浓度的NH4Cl和NaCl pH之和大于14
参考答案:C
本题解析:
本题难度:一般
5、选择题 20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
A.酸性HY>HX
B.结合H+的能力Y->CO
参考答案:B
本题解析:
本题难度:简单