时间:2019-05-30 05:44:20
1、填空题 25℃时,有0.01 mol/L的醋酸溶液,醋酸的电离平衡常数表达式_______________________达平衡时,溶液中氢离子浓度是___________________________(25℃时,醋酸的电离平衡常数为1.75×10-5)当向该溶液中加入一定量的盐酸时,电离常数__________________发生变化(填是否)
参考答案:K=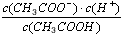 ;4.18×10-4 mol/L;否
;4.18×10-4 mol/L;否
本题解析:
本题难度:一般
2、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.HCN易溶于水
B.HCN溶液能导电
C.1mol/L氢氰酸溶液的pH约为3
D.10 mL1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
参考答案:C
本题解析:能溶于水的物质不一定是弱电解质如硝酸故A选项是错误的。能导电不能说明氢氰酸是弱电解质。弱电解质与强电解质的本质区别是,强电解质在水溶液中能完全电离,而若电解质不可以。C选项若氢氰酸是强酸则PH为0小于3,所以氢氰酸为弱酸。所以答案选C,而D选项无论氢氰酸是强酸还是弱酸都恰好能完全发生反应。
本题难度:简单
3、选择题 下列说法正确的是
A.物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等
B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等
C.100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等
D.100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等
参考答案:C
本题解析:
试题解析: 醋酸为弱酸,不能完全电离,等体积、等物质的量浓度的盐酸和醋酸,氢离子浓度不等,起始时反应的速率不等,故A错误;100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸,酸的物质的量相等,但溶液中氢离子浓度不等,分别与足量的锌反应时,两者放出H2速率不等,质量相等,故B错误;100 mL pH=3的H2SO4和HCl溶液,氢离子的物质的量相等,与足量锌反应后,放出H2的质量相等,故C正确;100 mL pH=3的盐酸与醋酸溶液,氢离子总量不相等,与足量锌反应后,所得H2的质量不等,故D错误。
考点:弱电解质的电离
本题难度:一般
4、选择题 关于醋酸溶液下列叙述错误的是?
[? ]
参考答案:D
本题解析:
本题难度:一般
5、选择题 在体积均为1L,pH均等于2的盐酸和醋酸溶 液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是
[? ]
A.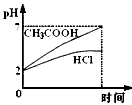
B.
C.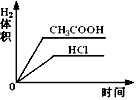
D.
参考答案:B
本题解析:
本题难度:一般