时间:2019-05-30 05:42:58
1、选择题 下列物质的体积一定是22.4 L的是。
A.标准状况下18 g水
B.17 g氨气
C.标准状况下44 g二氧化碳
D.0℃、2×105 Pa时2 g氢气
参考答案:C
本题解析:试题分析:18g水是1mol,但水在标准状况下,不是气体,体积不是22。4L;17g氨气是1mol,但氨气不一定是在标准状况下,体积不一定是22.4L;标准状况下44 g二氧化碳不是1mol,体积是22.4L;2g氢气是1mol,但氢气不是在标准状况下,体积不是22.4L,答案选C。
考点:考查物质的量的有关计算
点评:该题是中等难度的试题,试题注重基础和能力的双向考查,有利于培养学生的逻辑思维能力。该题的关键是明确在进行物质的量的有关计算时,要熟练应用几个关系式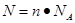 、n=m/M、
、n=m/M、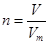 、
、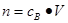 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:一般
2、选择题 若气体X与气体Y的摩尔质量之比为1∶2,则同温同压同体积的X、Y两气体的分子数之比为
A.1∶2
B.1∶1
C.2∶1
D.4∶1
参考答案:B
本题解析:
本题难度:一般
3、选择题 NA为阿伏加德罗常数,且已知C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300kJ?mol-1,则下列说法正确的是( )
A.当有20NA个电子转移时,放出2600kJ?热量
B.当有2NA个碳氧双键形成时,放出1300kJ热量
C.若生成NA个水蒸气分子焓变为△H1,则△H1<△H
D.上述反应为吸热反应
参考答案:A、当有20NA个电子转移时,转移电子物质的量为20mol,反应中氧元素化合价由0价降低为-2价,故参加反应的氧气的物质的量为20mol4=5mol,由热化学方程式可知2.5mol氧气反应放出热量为1300kJ,故当有20NA个电子转移时,放出的热量为1300kJ×5mol2.5mol=2600kJ,故A正确;
B、1个CO2分子中含有2个C=O双键,有2NA个C=O双键形成,说明有0.5molCO2生成,由热化学方程式可知2molCO2生成放出热量为1300kJ,2NA个C=O双键形成时,放出热量为1300kJ×0.5mol2mol=325kJ,故B错误;
C、气态水的能量比液态水的能量该,故生成气态水放出的热量少,反应热△H1增大,故C错误;
D、该反应的反应热符号为“-”,为放热反应,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列对于0.3 mol/L硫酸钾溶液的说法不正确的是
[? ]
A.1 L溶液中含有0.6NA个钾离子
B.1 L溶液中含有钾离子和硫酸根离子总数为0.9NA
C.2 L溶液中钾离子浓度为1.2 mol/L
D.2 L溶液中含有硫酸根离子0.6NA个
参考答案:C
本题解析:
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.铜与足量的稀硝酸反应生成4.48L气体时,转移的电子数为0.6NA
B.将硫溶于热的浓硫酸,当生成3moLSO2时,转移的电子数为4NA
C.常温常压下,4.6g的NO2和N2O4混合气体含有的原子数为3NA
D.标准状况下,22.4L氯气与足量的氢氧化钠溶液充分反应,转移的电子数为2NA
参考答案:A、没有告诉是标准状况下,故无法求算气体的物质的量,故A错误;
B、硫溶于热的浓硫酸,氧化产物和还原产物都是二氧化硫,生成3moLSO2时,消耗1molS,电子转移2mol电子,转移的电子数为2NA;
C、混合气体中,氮原子和氧原子的数是1:2,4.6g混合气体中,相当于含有0.1molNO2,含有3mol原子,原子数为3NA,故C正确;
D、氯气既是氧化剂也是还原剂,1mol氯气反应,转移1mol电子,故D错误;
故选C.
本题解析:
本题难度:一般