时间:2019-05-30 05:39:21
1、简答题 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
(1)金属腐蚀主要分为______腐蚀和______腐蚀两种.
(2)铁被腐蚀的速率由快到慢的顺序是______(填序号).
(3)①中正极的电极反应式为______,②中负极的电极反应式为______.
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上.为防护金属被腐蚀可采取的措施有______(填序号).
①健身器材刷油漆?②自行车钢圈镀铬
③将钢管用导线与铜条连接?④将钢管用导线与碳棒连接.
2、选择题 为了保护地下钢管不受腐蚀,可使它与( )
A.直流电源正极相连
B.铜板相连
C.锌板相连
D.直流电源负极相连
3、选择题 下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,完成(1)、(2)两题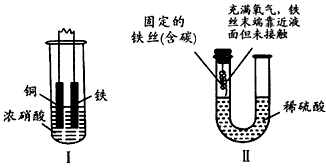
(1)下列叙述正确的是
[? ]
A.装置Ⅰ在反应过程中自始至终只生成NO2气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置I在反应结束时溶液中的金属阳离子只有Cu2+
(2)下列与反应原理相关的叙述不正确的是
[? ]
A.装置I中不可能发生如下反应:Fe +2Fe3+=3Fe2+
B.装置Ⅱ在反应结束时溶液中存在Fe2+
C.装置I的溶液若换为稀硝酸,则腐蚀过程与原装置不同
D.装置Ⅱ中的铁丝能发生电化学腐蚀
4、简答题 人类的生活离不开化学,生活中的化学无处不在.请回答:
(1)家用铁锅用水清洗后放置一段时间,出现红棕色的锈斑.此过程中不可能发生的变化有______(填序号).
①铁元素被氧化②铁元素被还原③铁元素由+3价转化为+2价
为防止铁锅生锈,将其洗净后,可进一步采取的措施是______(填序号).
①擦干②放在潮湿的地方
(2)抗酸药物的作用是中和胃里过多的盐酸.某抗酸药的主要成分是碳酸氢钠,写出碳酸氢钠与盐酸反应的离子方程式:______.若此抗酸药每片含碳酸氢钠0.40g,取此药一片研碎后与足量的盐酸反应,生成气体在标准状况下的体积为______L(精确到0.01).
5、选择题 下列说法正确的是? ( )。
A.原电池工作时,阴离子移向正极
B.铁片表面镀锌,铁片接电源负极
C.用Cu作电极电解H2O,阳极反应为:4OH--4e-===2H2O+O2↑
D.向AgCl饱和溶液中加入NaCl固体,c (Cl-)增大,Ksp增大