时间:2019-05-30 05:36:49
1、选择题 常温下,把1mL0.1mol/L的H2SO4加水稀释到2L溶液,在此溶液中由水电离产生的H+浓度接近于 (? )
A.1.0×10-4mol/L
B.1.0×10-8mol/L
C.1.0×10-11mol/L
D.1.0×10-10mol/L
参考答案:D
本题解析:C(H+)==10-4mol;故水电离的为10-10mol/L
本题难度:简单
2、选择题 在水中加入下列粒子,不能破坏水的电离平衡的是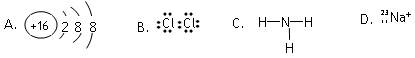
参考答案:D
本题解析:略
本题难度:简单
3、填空题 (12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
参考答案:(12分)(1)TiCl4+(x+2)H2O ? TiO2·xH2O↓+4HCl(2分)
? TiO2·xH2O↓+4HCl(2分)
(2) 250mL容量瓶(1分,必须答250mL,若无则无分)?甲基橙(1分)
(3)浅红色溶液变为无色,30秒内不褪色 (2分,两要点各1分)
(4)0.1250 mol?L-1 (4分,若不是4位有效数字无分)(5)偏高(2分)
本题解析:(1)TiCl4+(x+2)H2O ? TiO2·xH2O↓+4HCl
? TiO2·xH2O↓+4HCl
滴定终点的现象要半分钟不褪色,俯视标准液液面,水加少了,结果偏高。
本题难度:简单
4、填空题 (8分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4的燃烧热化学方程式是??。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:负极的电极反应式是??。
(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,充电时:阳极反应式:?用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:?
2PbSO4+2H2O,充电时:阳极反应式:?用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:?
参考答案:(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol;(2)N2H4+4OH--4e-=4H2O+N2↑
(3)PbSO4-2e-+2H2O==PbO2+SO42-+4H+? 3∶1
本题解析:(1)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量。32.0gN2H4的物质的量就是1mol,所以N2H4的燃烧热化学方程式是N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol;(20在燃料电池中,通入燃料的电极是负极,根据题意,在碱性环境中,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑;(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,[充电时:阳极发生氧化反应,该电极的电极反应式PbSO4-2e-+2H2O==PbO2+SO42-+4H+; (4)电解水的方程式是2H2O
2PbSO4+2H2O,[充电时:阳极发生氧化反应,该电极的电极反应式PbSO4-2e-+2H2O==PbO2+SO42-+4H+; (4)电解水的方程式是2H2O 2H2↑+O2↑。n(气体)=33.6 L÷22.4L/mol=1.5mol,则产生氧气0. 5mol,其质量16g,产生氢气1mol,质量是2.5 g.即1mol的H原子,质量是1.25 g,根据十字交叉法可得H:D=3:1。
2H2↑+O2↑。n(气体)=33.6 L÷22.4L/mol=1.5mol,则产生氧气0. 5mol,其质量16g,产生氢气1mol,质量是2.5 g.即1mol的H原子,质量是1.25 g,根据十字交叉法可得H:D=3:1。
本题难度:简单
5、填空题 (6分)已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
参考答案:(1)CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l);△H=" -726.5KJ/mol" (2分)
(2)-128.1 KJ/mol (2分)(3)D(2分)
本题解析:略
本题难度:简单