时间:2019-05-30 05:32:47
1、选择题 下列叙述正确的是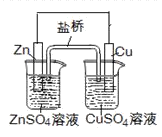
A.电镀时,通常把待镀的金属制品作阳极
B.上图Zn为负极,发生还原反应
C.上图电子由Zn电极流向Cu电极,盐桥中的Cl-移向CuSO4溶液
D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O
参考答案:D
本题解析:A.电镀时,通常把待镀的金属制品作阴极,错误;B.由于金属活动性Zn>Cu,所以Zn为负极,发生氧化反应,错误;C.右图电子由Zn电极流向Cu电极,盐桥中的Cl-移向正电荷较多的ZnSO4溶液,错误;D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-= 2H2O,正确。
考点:考查原电池、电解池的反应原理及应用的知识。
本题难度:一般
2、选择题 下图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是
[? ]
A.a极是负极
B.正极的电极反应是:O2+2H2O+4e-==4OH-
C.电子由b通过灯泡流向a
D.氢氧燃料电池是环保电池
参考答案:BC
本题解析:
本题难度:一般
3、选择题 燃料电池能量利用率可高达80%,下列有关燃料电池的说法错误?的是( )
A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,产物为水经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,负极反应为C2H5OH-12e-=2CO2↑+3H2O
D.H2SO4作电解质,甲烷燃料电池的正极反应为O2+4H++4e-=2H2O
参考答案:A、燃料电池中,燃料做负极,负极反应物可以是氢气、甲烷、乙醇等物质,故A正确;
B、航天飞行器中氢氧燃料电池的产物是水,经过处理之后可供宇航员使用,故B正确;
C、乙醇燃料电池的电解质用KOH时,生成的二氧化碳会和其反应生成碳酸盐,负极发生反应C2H5OH-12e-+16OH-=2CO32-+11H2O,故C错误;
D、在酸性环境下,燃料电池中正极反应为:O2+4H++4e-=2H2O,故D正确.
故选C.
本题解析:
本题难度:一般
4、选择题 在100 mLH2SO4和CuSO4的混合液中,用石墨作电极电解一段时间,两极均收到2.24L气体(标准状况),则原混合液中,Cu2+的物质的量浓度为(?)?
A.1mol?L―1? B.2mol?L―1? C.3 mol?L―1? D.4 mol?L―1
参考答案:A
本题解析:
正确答案:A
由电子守恒得:n(O2)×4= n(H2)×2+2n(Cu),
即0.1mol×4=0.1mol×2+2n(Cu),
n(Cu)=0.1mol,
Cu2+的物质的量浓度为
0.1mol÷0.1L?=1mol?L―1故A正确。
本题难度:简单
5、选择题 如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,在接通电路一段时间后纯Cu质量增加了3.2g.下列说法正确的是( )
A.甲池是电能转化为化学能的装置,乙池是化学能转化电能的装置
B.甲池中理论上消耗标准状况下空气的体积是2.8?L(空气中O2体积分数以20%计算)
C.接通电路一段时间后,乙池中CuSO4溶液的浓度发生了明显的变化
D.甲池通入CH3OH的电极反应为:CH3OH-6e-+2H2O=CO32-+8H+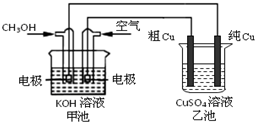
参考答案:A、甲池是甲醇燃料电池,是原电池的工作原理,化学能转化为电能,乙池是电解池,是电能转化为化学能,故A错误;
B、甲池中氧气是正极反应电极反应为:O2+2H2O+4e-=4OH-,乙池中纯铜电极析出铜的电极反应:Cu2++2e-=Cu,依据电池中的电子守恒,纯Cu质量增加了3.2g物质的量为0.05mol,转移电子为0.1mol,所以甲池消耗氧气0.025mol,标准状况下体积为0.025mol×22.4L/mol=0.56L,空气体积为=0.56L20%=2.8L,故B正确;
C、接通电路一段时间后,粗铜中含有铁锌镍等活泼金属,做电解池阳极时都会失去电子,同时纯铜阴极上析出铜;乙池中CuSO4溶液的浓度发生了明显的变化,故C正确;
D、甲池通入CH3OH的电极是原电池的负极发生的氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故D错误;
故选BC.
本题解析:
本题难度:一般