时间:2019-05-30 05:32:26
1、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是( )。
A.Na,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
参考答案:A
本题解析:根据金属的活动性顺序有下列冶炼方法:①从K~Al,用电解法;②Zn~Cu用还原剂(如H2,CO等)还原法;③Hg和Ag用加热分解法2HgO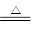 2Hg+O2↑。
2Hg+O2↑。
本题难度:简单
2、选择题 向m g镁、铜合金中加入稀硝酸溶液至合金恰好完全溶解(设硝酸的还原产物只有NO),向所得溶液中加入物质的量浓度为2 mol/L的NaOH溶液至沉淀达到最大值,产生沉淀的质量为(m + n)g,则下列有关叙述中不正确的是?
A.若n=5.1,则m的值可能为9.8
B.若n=5.1,则参加反应的硝酸的物质的量为0.4 mol
C.若n=5.1,则加入的NaOH溶液的体积为150 mL
D.若n =5.1,则被还原的硝酸的物质的量为0.1 mol
=5.1,则被还原的硝酸的物质的量为0.1 mol
参考答案:A
本题解析:略
本题难度:一般
3、选择题 为了检验FeCl2溶液是否氧化变质,可向溶液中加入的试剂是(?)
A.盐酸
B.KSCN溶液
C.氯水
D.石蕊溶液
参考答案:B
本题解析:A.FeCl2?、FeCl3都不与盐酸反应,所以不能检验是否变质,故A错误。
B.如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色现象明显,这一反应是Fe3+的特征反应,所以用KSCN溶液,故B正确。
C. FeCl2被氯水氧化成氯化铁,也不能检验是否变质。
D、无论氯化亚铁是否变质,都是强酸弱碱盐,溶液都呈酸性,所以无法检验,故D错误.
故选:B
点评:检验Fe3+的物质有:KSCN(溶液变血红色)、苯酚(溶液呈紫色)
本题难度:一般
4、填空题 某兴趣小组用废铁泥(主要成分为Fe2O3、FeO和少量Fe)制备磁性Fe3O4纳米材料的流程示意图如下: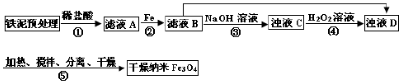
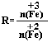 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。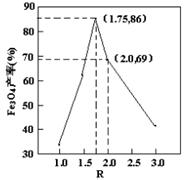
参考答案:(1)2Fe3++Fe=3Fe2+
(2)使亚铁离子沉淀完全
(3)2Fe(OH)2+H2O2=2FeOOH+2H2O
(4)a b c
本题解析:(1)滤液A中含有Fe3+,加入Fe后发生反应:2Fe3++Fe=3Fe2+
(2)Fe2+在pH=8.3时沉淀完全,所以步骤③中,用NaOH溶液调pH至9,亚铁离子沉淀完全。
(3)浊液C含有Fe(OH)2,加入H2O2,发生氧化还原反应,生成FeOOH,化学方程式为:2Fe(OH)2+H2O2=2FeOOH+2H2O。
(4)a、步骤④中,当反应完成后需再加热一段时间,可除去剩余的H2O2,正确;b、步骤⑤发生的反应为:2FeOOH+Fe2++2OH?=Fe3O4+2H2O,消耗OH?,所以需要不断补充碱液,正确;c、步骤⑤恰好反应时,生成Fe3O4,+3价的Fe与+2价的Fe物质的量之比为2:1,所以n(FeOOH)/n(Fe2+)=2:1,正确;d、根据图像可知,Fe3O4的产率最高时,+3价Fe与+2价Fe物质的量之比为1.75,所以当n(浊液D中FeOOH)/n(滤液B中的铁元素)=4/7时,Fe3O4的产率不是最高,错误。
本题难度:一般
5、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜、硅等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程: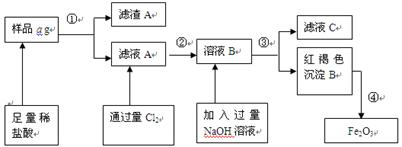
(1)取样品a g,称取时使用的主要仪器名称为_____?_______。
(2)滤液A中溶质主要含有_______??、__? __ _(写化学式);
操作①的名称?,其使用的玻璃仪器有______________________________。
(3)写出由溶液B生成红褐色沉淀B的离子方程式________________________________。
(4) 对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素的质量百分数的表达式为(用含a、b的式子表示)_____________。
(5)如何验证滤液A中含Fe2+,而不含Fe3+______________________?_____________。
参考答案:(1)托盘天平
(2) FeCl2、AlCl3 ; 过滤 ;?漏斗、烧杯、玻璃棒 。(错写不得分,漏写一个扣1分)
(3) Fe3+ + 3OH - ="=" Fe(OH)3↓
(4) (7b/10a)×100%? {或(70b/a)%}
(5)取少量滤液A于试管中,滴几滴KSCN溶液,溶液不变色,(2分)
再加氯水(或通氯气),溶液变为血红色。(1分)?(其他合理答案也可以)
本题解析:略
本题难度:一般