时间:2019-05-30 05:28:07
1、填空题 (8分)为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16g该气体燃料,完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903KJ的热量。请写出:
CNG的化学式?,其完全燃烧的热化学方程式?。
参考答案:CH4?CH4(g)+2O2 (g)=CO2(g)+2H2O(l) ?△H= -890.3kJ/mol
本题解析:考查热化学方程式的书写及反应热的有关计算等。
天然气的主要成分是甲烷,化学式是CH4;0.16g该气体燃料,完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903KJ的热量,则16g即1mol甲烷完全燃烧放出的热量应该是8.903KJ×100=890.3kJ,所以该反应的热化学方程式是CH4(g)+2O2 (g)=CO2(g)+2H2O(l)?△H= -890.3kJ/mol。
本题难度:一般
2、选择题 1909年丹麦科学家Sorensen用公式pH=-lgc(H+)引入pH,1999年荷兰科学家HenK Van Lubeck提出酸度(AG)的概念,以更好地表示溶液的酸碱性。酸度(AG)的定义为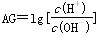 ?。 下列有关叙述中错误的是( )
?。 下列有关叙述中错误的是( )
A.常温时,中性溶液的pH=7,AG=0
B.酸性溶液 的AG>0,AG越大,溶液的pH越小
的AG>0,AG越大,溶液的pH越小
C.碱性溶液的AG>0,AG越大,溶液的pH越大
D.常温下,0.1 mol/LNaOH溶液,AG=-12,pH=13
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (6分)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)?。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)?
(3)将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) ?25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= ?。
(5)若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为 ?
参考答案:(1)④②③①?(2)⑥⑦④⑤⑧?(3)c(Na+)> c(CH3COO-) >c(OH-)>c(H+)
(4)>;9:2? (5) 10(a+b-12)%
本题解析:考查弱电解质的电离以及pH的有关计算。
(1)水在溶液中存在电离平衡H2O H++OH-,所以酸或碱均是抑制水的电离,如果氢离子浓度和OH―如果相同,对水的电离抑制程度就相同的。盐的水解可以促进水的电离。硫酸是二元强酸,醋酸是一元弱酸,氢氧化钠是一元强碱,氯化铵溶于水存在水解平衡,所以由水电离出的H+浓度由大到小的顺序是④②③①。
H++OH-,所以酸或碱均是抑制水的电离,如果氢离子浓度和OH―如果相同,对水的电离抑制程度就相同的。盐的水解可以促进水的电离。硫酸是二元强酸,醋酸是一元弱酸,氢氧化钠是一元强碱,氯化铵溶于水存在水解平衡,所以由水电离出的H+浓度由大到小的顺序是④②③①。
(2)氨水是弱碱部分电离,所以NH4+浓度最小。另外四种属于铵盐,NH4+水解显酸性,⑦中能电离出大量的氢离子,抑制其水解,⑤中阳离子和阴离子均水解,相互促进。所以溶液中NH4+浓度由大到小的顺序是⑥⑦④⑤⑧。
(3)②和③等体积混合后,二者恰好反应生成醋酸钠,醋酸钠水解显碱性,所以混合液中各离子浓度由大到小的顺序是c(Na+)> c(CH3COO-) >c(OH-)>c(H+)。
(4)电离是吸热的,所以升高温度,促进水的电离,离子积常数增大。所得混合溶液的pH=2,说明硫酸是过量的。pH=11的NaOH溶液,则OH―的浓度为0.01mol/L,硫酸中氢离子是0.1mol/L,所以有 ,解得a∶b=9∶2。
,解得a∶b=9∶2。
(5)pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则氨水的浓度和元素的浓度相等,都是10-bmol/L,根据氨水的电离方程式和pH可计算氨水中已电离的一水合氨的浓度为10a-14mol/L,所以室温下氨水的电离度为 。
。
本题难度:一般
4、选择题 水的电离过程为H2O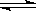 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是?(?)
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是?(?)
A.c(H+)随着温度升高而升高
B.35℃时,c(H+)>c(OH-)
C.水的电离度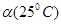 <
<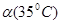
D.水的电离是吸热的
参考答案:B
本题解析:根据不同温度下水的离子积可知升高温度,平衡正向移动,所以水的电离是吸热的,c(H+)、c(OH-)随着温度升高而升高,但c(H+)=c(OH-),所以B项错误。答案选B。
点评:温度升高水的电离程度增大,但是c(H+)=c(OH-),溶液呈中性。
本题难度:一般
5、选择题 室温时,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为
A.V(酸)=102V(碱)
B.V(碱)=102V(酸)
C.V(酸)=2V(碱)
D.V(碱)=2V(酸)
参考答案:B
本题解析:根据溶液的PH分别计算溶液中c(H+)和c(OH-),酸碱溶液混合pH=7,则说明n(H+)=n(OH-),以此进行计算,强酸溶液pH=a,则c(H+)=10-amol/L,强碱溶液pH=b,则c(OH-)=10b-14mol/L,酸碱溶液混合pH=7,则说明n(H+)=n(OH-),则有:V(酸)×10-amol/L=V(碱)×10b-14mol/L,答:碱溶液体积V(碱)和酸溶液体积V(酸)的关系为V(碱)=102V(酸)
点评:考查酸碱混合的计算,题目难度中等,注意从酸碱溶液混合pH=7,n(H+)=n(OH-)的角度解答。
本题难度:简单