时间:2019-05-30 05:28:07
1、选择题 关于用水制取二级能源氢气,以下研究方向不正确的是
A.水由氢氧两种元素构成,可研究在水分解的情况下,使氢能成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找特殊化学物质,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源以分解水制取氢气
2、填空题 (9分)在常温下,下列五种溶液:
①0.1mol/L NH4Cl?②0.1mol/L CH3COONH4?③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液?⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈??性(填“酸”、“碱”或“中”),其原因是?用离子方程式表示)
(2)在上述五种溶液中,pH最小的是?;c(NH4+)最小的是??﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是②?③﹝填“>”、“<”或“=”)
(4)在溶液④中,?离子的浓度为0.1mol/L;NH3·H2O和?离子的物质的量浓度之和为0.2 mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) ???c(NH4+)(填“>”、“<”或“=”)
3、填空题 测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否不断溶解?________(填“能” 或“不能”),理由是____________________________________________________。
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果________(填“偏高”“偏低”或“无影响”)。原因是_________________________________________________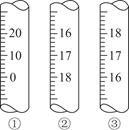
(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选________(填序号),在滴定接近终点时,应用蒸馏水润洗锥形瓶内壁,目的是________________________________________________________
4、填空题 已知下列热化学方程式:?
①2H2(g) +O2(g)=2H2O(l)? ΔH=" -" 570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g)? ΔH=" -" 483.6 kJ·mol-1?
③H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)? ΔH= --114.6kJ·mol-1?
回答下列问题:
H2的燃烧热为?;反应③的中和热为?。
5、选择题 将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是( )
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)