时间:2019-05-30 05:21:57
1、填空题 (12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:
。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。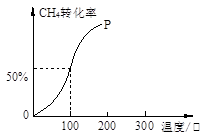
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A c(H2)减少 B 正反应速率加快,逆反应速率减慢
C CH3OH 的物质的量增加 D 重新平衡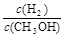 减小
减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程: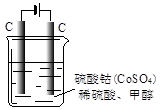
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
2、填空题 (9分)写出298 K时,下列反应的热化学方程式:
(1)1mol HgO(s)分解为液态汞和氧气,吸热90.7 kJ。____________________________________
(2)在稀溶液中1 mol H2SO4与足量NaOH反应放热114.6 kJ,表示该中和热的热化学方程式为
(3)在101 kPa时,H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为 ,表示H2燃烧热的热化学方程式为_
(4)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知N2 (g) + 2O2 (g) =2NO2 (g) △H ="+67.7" kJ/mol
N2H4 (g) +O2 (g) =N2 (g) + 2H2O (g) △H =" -534" kJ/mol
则N2H4 (g)和二氧化氮反应的热化学方程式为
3、选择题 标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A.H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
4、选择题 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Br2(g)→2HBr(g)+Q1kJ ;
H2(g)+I2(g) 2HI(g) -Q2 kJ 有关上述反应的叙述正确的是?
2HI(g) -Q2 kJ 有关上述反应的叙述正确的是?
[? ]
5、填空题 按要求写热化学方程式:
(1)已知稀溶液中,1?mol?H2SO4与NaOH溶液恰好完全反应时,放出114.6?kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式________________________________。
(2)25℃、101?kPa条件下充分燃烧一定量的丁烷气体放出热量为Q?kJ,经测定,将生成的
CO2通入足量澄清石灰水中产生25?g白色沉淀,写出表示丁烷燃烧热的热化学方程式__________________________________。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)?ΔH1=-870.3?kJ/mol
②C(s)+O2(g)===CO2(g)?ΔH2=-393.5?kJ/mol
③H2(g)+1/2O2(g)===H2O(l)?ΔH3=-285.8?kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式 _______________________________________。